高校化学 天然高分子化合物
高等学校 生物基礎の履修を前提とする。必要があれば高等学校 生物も参照。
糖類
[編集]多数のヒドロキシ基を持つ、分子式 で表される化合物を糖類(saccharides)または炭水化物(carbohydrate)という。
それ以上加水分解しない最小の糖類を単糖という。単糖2分子が脱水縮合した糖類を二糖(disaccharide)、単糖2~10分子程度が脱水縮合した糖類をオリゴ糖、多数の単糖が脱水縮合した糖類を多糖(polysaccharide)という。
水溶液中で鎖式構造がホルミル基をもつ糖をアルドース(aldose)、カルボニル基をもつ糖をケトースという。
主な単糖として、グルコース、フルクトース、ガラクトース。
主な二糖として、マルトース、スクロース、ラクトース、セロビオース。
主な多糖として、デンプン、セルロースが挙げられる。
投影式
[編集]糖類の立体配置を表すためにハース投影式とフィッシャー投影式を用いる。 ハース投影式では、上方向に出ている結合は環から上向きに、下方向に出ている結合は環から下向きに出るように書かれる。

フィッシャー投影式では、十字の中心は不斉炭素原子とし、左右の結合は紙面(画面)の手前に、上下の結合は紙面(画面)の奥に出る。

単糖
[編集]炭素数5の単糖をペントース、炭素数6の単糖をヘキトースという。
グルコース
[編集]グルコース(glucose、葡萄糖、ブドウ糖) は、デンプンを加水分解することによって得られる。
- (C6H10O5)n + nH2O → nC6H12O6
グルコースは甘味をもち、また、水によく溶ける。水溶液中のグルコースは、一部のグルコースの環構造が開き鎖式構造に変わる。ホルミル基を持つアルドースであるため、還元性を示す。従って、銀鏡反応やフェーリング反応を示す。
一般に、開環してときにできる構造は還元性を示す。開環する条件は、環内の酸素原子に結合している炭素原子にさらにヒドロキシ基が結合していることである(ヘミアセタール構造)。酸素原子とヒドロキシ基が近づくと脱水反応を起こして開環する。
グルコースは水溶液中でαグルコースと鎖式グルコースとβグルコースの3種類の構造を持つ。
αグルコースを水に溶かすと、一部が鎖式グルコースになり、さらにその一部が鎖式構造を経てβグルコースになる。最終的に、α形、鎖式、β型の3種類のグルコースが混じりあった平衡状態になる。

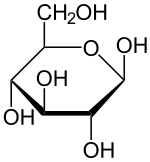
一般に、6位の炭素を含むを紙面奥側に配置したとき、ヒドロキシ基が環の上側にあるものがα型、下側にあるものがβ型である。
なお、葡萄糖という名前の由来は、グルコースの結晶が葡萄のような見た目になることである。
フルクトース
[編集]フルクトース(fructose、果糖'、fruit sugar ) は水溶液中で、一部が鎖式フルクトースを経て、五員環フルクトース(フルクトフラノース)、六員環フルクトース(フルクトピラノース)になる。五員環フルクトースと六員環フルクトースにはα型とβ型が存在するため、フルクトースは水溶液中では5種類の構造が存在する。 ※五員環の糖類をフラノース型、六員環の糖類をピラノース型という。
フルクトースはケトースである。

鎖状構造のフルクトースにはホルミル基は無いが、一部が異性化し、ホルミル基を持つので還元性を示す。


フルクトースは、天然に存在する糖類の中で最も甘く、果実や蜂蜜などに含まれることが多い。
余談だが、ジュースの成分表示を見ると「高果糖液糖」「果糖ブドウ糖液糖」「ブドウ糖果糖液糖」という文言が見られる。これは、そのジュースの果糖の含有量の指標であり、それぞれ、90%以上、90~50%、50%未満を表す。果糖は葡萄糖よりも中性脂肪になりやすく、甘みが強いのに対して満足感を得にくいので、摂取しすぎに注意しよう。
アルコール発酵
グルコースやフルクトースなどの6炭糖(ヘキトース)は酵素群チマーゼによってアルコール発酵を起こす。
このとき、ATPを2分子合成する。
ガラクトース
[編集]ガラクトースはグルコースの4位の不斉炭素原子の立体配置が異なる単糖である。寒天の成分であるガラクタンを加水分解すると、ガラクトースが得られる。ヘミアセタール構造が存在するので、水溶液は還元性をしめす。

ニ糖類
[編集]
二糖類を構成する単糖類の縮合したエーテル結合をグリコシド結合という。 主な二糖類には、スクロース、マルトース、セロビオース、ラクトースがある。
ヘミアセタール構造
[編集]有機化合物中の、ある一つのC原子に対して、そのC原子にヒドロキシル基 -OH とエーテル結合 -O- が隣り合ってる構造を、ヘミアセタール構造という。グルコースで、ヘミアセタール構造をもつのは、一箇所だけである。水溶液中のグルコースでは、このヘミアセタール構造が変形してアルデヒドを形成している。
このヘミアセタール構造の有無を、糖類の構造式を見て調べることで、糖類の水溶液中の還元性を予測できる。まず、構造式中のエーテル結合-O- を持つ部分を探してそのOに隣り合ったC原子が-OH を持つかどうかでヘミアセタール構造の有無を判別する。
スクロース
[編集]
スクロース(sucrose、蔗糖)は、αグルコースとβフルクトフラノースがα-1,2-グリコシド結合した構造をもつ。
スクロースの水溶液は還元性を示さない。これは、グルコースとフルクトースの還元性をしめすヘミアセタール構造の部分で縮合が行われていることによる。
砂糖の主成分であり、サトウキビやテンサイに含まれる。
- 加水分解
希酸または酵素スクラーゼ(インペルターゼ)でスクロースを加水分解すると、グルコースとフルクトースの等量混合物になる。
C12H22O11 (スクロース) + H2O → C6H12O6(グルコース) + C6H12O6 (フルクトース)
グルコースとフルクトースの等量混合物を転化糖(invert sugar)という。スクロースを加水分解すると転化糖が得られる。
マルトース
[編集]
(麦芽糖)
αグルコース2分子が1位と4位で脱水縮合した構造。
- 特徴
還元性を示す。
- 加水分解
希酸または酵素マルターゼで加水分解される。
デンプンを酵素アミラーゼで加水分解するとマルトースが生じる。
大根の汁にはジアスターゼが含まれているので、澱粉をマルトースに分解して大根飴を作る。
セロビオース
[編集]
セロビオースはβ-グルコース2分子がβ-1,4-グリコシド結合した二糖である。
セルロースに酵素セルラーゼを作用させると加水分解しセロビオースが生じる。
ラクトース
[編集]
(乳糖)
ラクトース(lactose)は、ガラクトースとαグルコースが縮合した構造。
- 特徴
ラクトースの水溶液は還元性を示す。
- 加水分解
酵素ラクターゼによってラクトースは加水分解され、ガラクトースとグルコースになる。
牛乳など、哺乳類の乳汁にラクトースは含まれる。
体内のラクターゼが少ない人は乳製品を摂取すると下痢を引き起こす。
トレハロース
[編集]
トレハロースの構造は、αグルコースが2分子からなり、αグルコースの1位の還元基どうしが結合した構造となっている。このことからもわかるように、トレハロースの水溶液は還元性を示さない。
自然界では、昆虫の体液、キノコやカビ、海藻などに含まれる。
| 名前 | 構成する単糖 | グリコシド結合 | 還元性 |
|---|---|---|---|
| スクロース | グルコース+フルクトース | α-1,2 | なし |
| マルトース | グルコース+グルコース | α-1,4 | あり |
| セロビオース | グルコース+グルコース | β-1,4 | あり |
| ラクトース | ガラクトース+グルコース | β-1,4 | あり |
| トレハロース | グルコース+グルコース | α-1,1 | なし |
多糖類
[編集]デンプン
[編集]デンプン(starch)は、植物が光合成によって体内につくる多糖類である。二糖類とちがい、デンプンは甘味をしめさない。また、デンプンは、還元性を示さない。 デンプンは、多数のαグルコースが脱水縮合して出来た構造をもつ多糖類の高分子化合物である。 (C6H10O5)n の構造を持つ。nは数百から数十万である。
- デンプンの性質
デンプンは冷水には溶けにくいが、約80℃の熱水には溶けてコロイド状のデンプン糊になる。
酵素アミラーゼによって、デンプンは加水分解される。このアミラーゼによるデンプンの加水分解の結果、デンプンの重合数が少なくなったデキストリン(C6H10O5)n を生じる。そしてデキストリンは、さらに二糖類のマルトースに分解される。
マルトースに対しては、酵素マルターゼによって、グルコースになる。
デンプンからグルコースまでの順序を化学式にまとめれば、
(C6H10O5)n デンプン→ (C6H10O5)m デキストリン → C12H22O11 マルトース→ C6H12O6 グルコース
である。(デンプンとデキストリンの重合数について、n>mとした。)
デンプンには還元性は無い。したがってデンプンは、フェーリング液を還元しない。
ヨウ素デンプン反応
[編集]
ヨウ化カリウム水溶液KIにより、デンプンは青紫色に呈色する。加熱すると、無色になる。この反応をヨウ素デンプン反応(iodine-starch reaction)という。
デンプンは水溶液中では、分子内の水素結合により、螺旋構造をとる。この螺旋構造の中にヨウ素が入りこむことで、呈色する。 加熱で無色になっても、冷却すると、再び、もとの青紫色の呈色を示すようになる。
アミロースとアミロペクチン
[編集]

デンプンの種類のうち、αグルコースが直鎖状に結合したものをアミロース(amylose)と言う。αグルコースが、ところどころ枝分かれした構造のデンプンをアミロペクチン(amylopectin)という。枝分かれの割合はαグルコース数十個につき、一個の枝分かれの程度である。
もち米のデンプンは、アミロペクチンが100%である。ふつうの植物のデンプンには、アミロースが20%程度でアミロペクチンが80%程度ほど含まれている。
- アミロース
グルコースの1位と4位が結合して重合した構造になっている。直鎖状に結合するが、水素結合により螺旋構造をとる。 ヨウ素デンプン反応では、アミロースは青色。多くのヒドロキシ基を持ち、極性を持つ部分が多いため、熱湯には、比較的、溶けやすい。冷水には溶けにくい。 分子量は5桁〜6桁である。
- アミロペクチン
グルコースの1位と4位が結合して重合したほかに、1位と6位が結合した重合構造になっている。 1位と6位の結合のため、構造に枝分かれ上の分岐が起こる。 ヨウ素デンプン反応では、アミロペクチンは赤紫色。アミロースとの色の違いは、直鎖状の長さの違いによって、ヨウ素との結合力に違いが生じたからある。ヨウ素と反応することから分かるように、アミロペクチンも螺旋構造を取る。枝分かれをするものの、分かれた枝の先がそれぞれ螺旋構造をとる。 熱湯には、溶けにくい。冷水にも溶けにくい。 分子量は6桁〜7桁である。
グリコーゲン
[編集]
グリコーゲン(glycogen)は、動物の肝臓に多い多糖類で、その構造はアミロペクチンと似ているが、アミロペクチンよりも枝分かれが多い。分岐の頻度は、おおむね8~12基に一回の程度の分岐である。枝分かれが多いため放射したような網目構造をとり、螺旋構造をとらない。このため、極性をもった部分が外側に出やすく、水溶性が高い。 ヨウ素デンプン反応では、グリコーゲンは赤褐色を示す。
- グリコーゲンを含む生体には、動物の体内で栄養素として多いことから、動物デンプンともよばれる。
- グリコーゲンは肝臓や筋肉に多く含まれる。
生物史的には、饑餓状態でも獲物を捕まえる時のエネルギー源としてグリコーゲンを利用できた種族が生き残ったと考えられている。
セルロース
[編集]

セルロース(食物繊維、cellulose)[C6H7O2(OH)3]n は植物の細胞壁の主成分である。木綿、パルプ、ろ紙は、ほぼ純粋なセルロースである。セルロースの構造は、多数のβグルコースが、直線状に縮合した構造である。セルロースの構造では、各グルコースの向きが交互に表・裏・表・裏を繰り返すので、セルロース全体で見れば直線状になっている。分子が平行に並ぶので、水素結合で強い繊維状になる。
- セルロースは、還元性を持たず、また、ヨウ素デンプン反応も示さない。
- セルロースは、冷水や熱水には溶けない。セルロースは、エーテルやアルコールなどにも溶けない。
- セルロースはシュバイツアー試薬に溶ける。
シュバイツアー試薬とは、水酸化銅Cu(OH)2を濃アンモニア水に溶かしたものである。水溶液中でイオンが、深青色のテトラアンミン銅(Ⅱ)イオン[Cu(NH3)4]2+ になる。
セルロースの示性式は、[C6H7O2(OH)3]n である。グルコース1単位あたり3個のヒドロキシ基OHを持つ。したがって、酸と反応させるとエステルを作りやすく、酢酸や硝酸とエステルをつくる。
セルロースは、酸を加えて長時間加熱すると、最終的にグルコースになる。
このほか、酵素セルラーゼによって、セルロースはセロビオースに分解される。人間はセルラーゼを持たないため、セルロースをエネルギー源にすることは不可能である。草食動物は、胃の中に飼っているバクテリアがセルラーゼを持つのでグルコースまで消化することができるが、非常に時間がかかりかつ摂取できる栄養がそこまで多くないので、反芻や爆食いの原因となっている。なお、草食動物の糞はほぼ草そのままである。
工業上は硝酸とのセルロースのエステルである「ニトロセルロース」(後述する。)が、特に重要である。
セルロースの誘導体
[編集]ニトロセルロース
[編集]セルロース[C6H7O2(OH)3]nに、混酸を作用させると、セルロースのOH基の一部または全部がエステル化される。セルロース中のグルコース1単位あたり、3個のOH基の一部または3個全部が硝酸エステル化されたものをニトロセルロース(nitrocellulose)という。特にセルロース中のグルコース1単位のうち、3個のOH基すべてが硝酸エステル化されたもの [C6H7O2(ONO2)3]n をトリニトロセルロースという。
※硝酸(NO2-OH)とアルコール(R-OH)は脱水縮合(これもエステル化という)を起こして硝酸エステル(R-O-NO2)を形成する。
このトリニトロセルロースは火薬の原料である。また、手の上で燃やしても火傷しない綿火薬としても用いられる。
ジニトロセルロース
[編集]セルロース中の2個のOH基がエステル化したものはジニトロセルロースという。このジニトロセルロースは、有機溶媒に溶ける。
- コロジオン
このジニトロセルロースを、エタノールとエーテルの混合液に溶かしたものをコロジオンという。混合液には水分などを含まないので「水溶液」では無いことに注意。 コロジオンの溶液を蒸発させると、薄い膜が残る。これは半透膜の材料に使われる。コロジオンから得られた半透膜のことをコロジオン膜ともいう。
- セルロイド
ニトロセルロースをエタノールに溶かし、ショウノウを加えて得られる樹脂をセルロイドという。セルロイドはかつて玩具や眼鏡に用いられたが、高い可燃性からあまり用いられなくなった。昭和時代の人形にプレミア価格がつくのは、このセルロイドが原料だからである。
アセテート類
[編集]セルロースを無水酢酸、氷酢酸および少量の濃硫酸との混合物を反応させる。すると、分子中のOH基中のHがCOOH基で置換されるアセチル化が起きて、トリアセチルセルロースが生成する。
トリアセチルセルロースは映画用フィルムや生分解性プラスチックに用いられる。これらが劣化すると酸っぱい臭いを発するのは、分解によってトリアセチルセルロースから酢酸が生じるためである。
トリアセチルセルロースはヒドロキシ基OHを持たないため、通常の溶媒(メタノール等)には溶解しづらい。しかし、トリアセチルセルロースは常温の水または温水で、エステル結合の一部が加水分解してジアセチルセルロース[C6H7O2(OH)(OCOCH3)2]nになる。このジアセチルセルロースはヒドロキシ基をもつので、アセトン溶媒に溶解するようになる。このジアセチルセルロースの溶けたアセトン溶液を細孔から押し出してアセトンを蒸発・乾燥させて、紡糸したものをアセテート繊維という、あるいは単にアセテートという。 語「アセテート」の意味は、「酢酸エステルの」という意味である。
アセテート繊維のように、天然繊維を化学的に処理してから紡糸した繊維を半合成繊維(semisynthetic fiber)という。
レーヨン
[編集]天然繊維を溶媒に溶かしたのち、再び繊維に戻したものを再生繊維(regenerate fiber)という。セルロースの再生繊維はレーヨン(rayon)と呼ばれ、レーヨンにはビスコースレーヨンと銅アンモニアレーヨンがある。
- 銅アンモニアレーヨン
水酸化銅(II)であるCu(OH)2を濃アンモニア溶液に溶かした溶液をシュバイツアー試薬という。このシュバイツアー試薬溶液にセルロース(具体的には脱脂綿など)を溶かすと、粘度のある液体が得られる。この粘い液体を細孔から希硫酸の中にゆっくり押し出すと、セルロースが再生する。こうして得られた繊維を銅アンモニアレーヨンまたはキュプラといい、光沢があり、滑らかであり、柔らかいので、衣服の裏地に利用される。
- ビスコースレーヨン
セルロース(具体的には脱脂綿など)を濃い水酸化ナトリウム溶液に浸す処理をしてアルカリセルロース(化学式は[C6H7O2(OH)2ONa]nである。)にしてから、紙などで挟んでから絞って水気を切って、つぎに二硫化炭素CS2と反応をさせると、セルロースキサントゲン酸ナトリウム(式は[C6H7O2(OH)2OCSSNa]nである。)という物質になる。これを水酸化ナトリウム水溶液に溶かすと、赤褐色のコロイド溶液が得られる。こうして、セルロースから得られた赤褐色のコロイド溶液をビスコース(viscose)という。このビスコースを、細孔から希硫酸の中に押し出して、セルロースを再生させて紡糸したものが、ビスコースレーヨン(viscose rayon)という繊維である。
そして、ビスコースを細孔からではなく、細長いすきまから膜上に押し出したものをセロハン(cellophane)といい、テープや包装材に利用される。
- 再生繊維
レーヨンのように、天然繊維を一度化学的に処理して溶液にした後、糸として、元の化学式を再生させた繊維を再生繊維という。 なお、アセテート繊維は化学式が変わっているので再生繊維でない。アセテート繊維は化学式が元のセルロースから変わっている繊維で、また人工物だけから得られた合成繊維でもないので、アセテート繊維などは半合成繊維という。
タンパク質とアミノ酸
[編集]アミノ酸
[編集]
分子中にアミノ基( -NH2 )とカルボキシル基( -COOH )をもつ化合物をアミノ酸(amino acid)という。アミノ酸のうち、同一の炭素C原子に、-NH2と-COOHが結合しているアミノ酸をαアミノ酸という。一般に、カルボキシ基の結合している炭素原子をαとし、その隣の炭素原子をβ, γ, δ, ε,・・・と命名し、どの炭素原子にアミノ基が結合しているかでβアミノ酸、γアミノ酸・・・のように分類する。が、高校範囲ではαアミノ酸以外登場しない。
アミノ酸の一般式は
- R-CH(NH2)-COOH
で表される。Rは炭化水素基(アルキル基)あるいは水素などである。 なお、R-の部分をアミノ酸の側鎖(そくさ)という。Rの違いによって、アミノ酸の種類が決まる。
- ※ なお、生体のタンパク質は、約20種類のαアミノ酸が成分となって縮合してできる物である。生体に必要なアミノ酸のうち、体内で合成されない・合成されにくいアミノ酸を必須アミノ酸(essential amino acid)という。動物によって必須アミノ酸は異なる。
鏡像異性体
[編集]
グリシン以外のすべてのアミノ酸には鏡像異性体(enantiomer)が存在する[1]。 天然のアミノ酸のほとんどは、L型の配置である。D型の配置のアミノ酸は、天然にはほとんどない。
アミノ酸の反応
[編集]
アミノ酸のカルボキシ基-COOH は、アルコール(CH3OH など)と反応しエステル化をしてエステルをつくる。また、アミノ酸のアミノ基-NH3は無水酢酸( (CH3CO)2O )と反応させるとアセチル化してアミドをつくる。
双性イオン
[編集]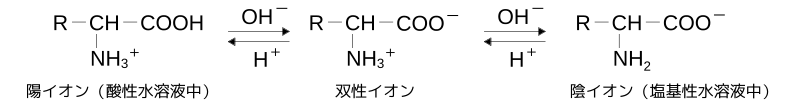
結晶中のアミノ酸分子中では、分子内で( -COOH )が水素Hを( -NH2 )に渡して、アミノ酸内にイオンの( -COO- )と( -NH3+ )を生じる。その結果、アミノ酸の構造は、
R-CH(NH3+)-COO-
の構造になる。このように分子内に酸性と塩基性の両方のイオンを生じるので、双性イオン(zwitterion)とよばれる。 このようにイオンがあるため、アミノ酸は水に溶けやすく、また、有機溶媒には溶けにくい。双性イオンの陽イオンと陰イオンどうしがクーロン力で引き合うため、アミノ酸はイオン結晶に近い結晶構造を取り、また、ほかの有機化合物と比べるとアミノ酸は比較的に融点や沸点が高い。
アミノ酸の水溶液に外部から酸をくわえると、平衡がかたむき、-COO-がH+を受け取り -COOHになるので、アミノ酸分子中で-NH3+が余るので、酸性が強い溶液中ではアミノ酸は陽イオンになる。
いっぽう、アミノ酸の水溶液に外部から塩基をくわえると、平衡がかたむき、-NH3+がOH-にH+を放出することによって-NH2と変わることによって、-COO-が余るので、アミノ酸は陰イオンになる。
等電点
[編集]水溶液中でアミノ酸の陽イオンと陰イオンの個数が等しいときのpHを等電点(isoelectric point)という。等電点ではアミノ酸溶液の電荷の総和が0になる。
アミノ酸の水溶液を染み込ませた紙に、2本の電極で電圧を加え電気泳動をおこなうと、等電点よりpHが小さい水溶液中では、アミノ酸は陽イオンになっているため、陰極側に移動する。いっぽう、等電点よりpHが大きい水溶液では、アミノ酸は陰イオンとなり、陽極側に移動する。
そして、pHが等電点と同じくらいの水溶液中だと、アミノ酸は陽極にも陰極にも移動しないので、このときの水溶液のpHを測定することにより、等電点を測定できる。
アミノ酸の等電点は、グリシンでは pH6.0 、酸性アミノ酸のグルタミン酸ではpH3.2、塩基性アミノ酸のリシンでは9.7である。
水溶液が中性付近では、ふつうは双対イオン状態のアミノ酸が最も多く、陰イオン状態のアミノ酸や陽イオン状態のアミノ酸は少ししか存在しない。
等電点は化学平衡の考え方を用いて求めることができる。
アミノ酸の電離平衡は以下の二段階反応式で表される。
双性イオンは全体の電荷が0なので、そのイオン濃度は計算に不要である。よって、二段階の反応の平衡定数を掛けて双性イオンのモル濃度を消去する。※
等電点ではなので、
pHの定義はなので、
が等電点の値である。
※の考え方は、二段階反応の平衡定数を考えるとき全般に使える。
ニンヒドリン反応
[編集]
アミノ酸水溶液に薄いニンヒドリン水溶液を加えて温めると、アミノ基 -NH2 と反応して、色が青紫~赤紫になる。この反応をニンヒドリン反応(ninhydrin reaction)といい、アミノ酸の検出などの目的に用いられる。この反応は、アミノ酸の検出やタンパク質の検出に利用される。なお。タンパク質も、構造の端部などにアミノ酸をふくむため、少しながらニンヒドリン反応をするので、色が青紫〜赤紫になる。
なお、ニンヒドリンは一つの炭素にヒドロキシ基が二つ結合した構造を持つが、この構造は普通すぐに脱水縮合を起こすため、この構造が維持されているのは驚くべきことである。
アミノ酸の例
[編集]- 必須アミノ酸
フェニルアラニンやリシン、メチオニンは必須アミノ酸の例である。 必須アミノ酸は、ヒトの体内で合成されないバリン、ロイシン、イソロイシン、トレオニン、メチオニン、フェニルアラニン、トリプトファン、リシンの8種類に、合成されにくいヒスチジンを加えた9種類である。幼児では、さらにアルギニンを加える場合もある。
- グルタミン酸
グルタミン酸は、昆布のうま味の成分である。グルタミン酸には光学異性体があり、L型のグルタミン酸のみが うま味 を示す。一方でD型はうま味を示さず、若干の苦味を伴う
タンパク質
[編集]ペプチド結合
[編集]
2個のアミノ酸分子が結合し、いっぽうのアミノ酸のカルボキシル基と、もう一方のアミノ酸のアミノ基が縮合して、脱水縮合して結合をペプチド結合(peptide bond)という。それぞれのアミノ酸は同一種でなくても良い。また、ペプチド結合によって生成する化合物をペプチド(peptide)という。
ペプチドのうち、2分子のアミノ酸がペプチド結合したものをジペプチド(dipeptide)という。3分子のアミノ酸がペプチド結合したものをトリペプチド(tripeptide)という。多数のアミノ酸が縮合重合したものをポリペプチド(polypeptide)という。
ジペプチドには、ペプチド結合が1つ存在する。トリペプチドには、ペプチド結合が2つ存在する。
ポリペプチドのうち、分子量が約5000を超えるものをタンパク質(蛋白質、protein)という。筋トレに欠かせないプロテインの語源はこれである。なお、プロテインの成分は主に分岐鎖アミノ酸(branch chair amino acid、BCAA)である。
ペプチド化合物で縮合に使われなかったアミノ基が末端に残るが、このペプチド化合物の縮合に使われなかった末端のアミノ基をN末端という。同様に、カルボキシル基も末端に残るが、これをC末端という。ペプチドの構造式を書くときは、N末端を左側に、C末端を右に配置して書くのが慣行である。
ジペプチドには、構造異性体が存在する。たとえば、グリシン(Gly)とアラニン(Ala)からなるジペプチドについて、グリシンのCOOH基とアラニンのNH2基が結合したものを、グリシルアラニン(Gly-Ala) という。また、グリシンのNH2基とアラニンのCOOH基が結合したものを、アラニルグリシン(Ala-Gly )という。 グリシルアラシンもアラニルグリシンも、原子数は同じであるが、構造は異なる。
なお、ペプチドの名称は、このグリシルアラニンの例のように、N末端を持つグリシンが名称の先に来て、C末端をもつアラニンがあとに来る。
トリペプチドやポリペプチドの表記でも同様に、N末端からC末端のアミノ酸の名称で表記する。
トリペプチドでも、ジペプチドと同様に構造異性体が存在する。 なお、グルタミン酸は、カルボキシル基を2箇所もつので、グルタミン酸を含むペプチドでは、構造異性体の数が2倍に増える。
例として、いくつかのトリペプチドで構造異性体の数を求める。
- 例1:
GlyとGlyとAlaが結合したトリペプチドの場合。(Glyが2分子。)
構造順はGly-Gly-Ala と Gly-Ala-GlyとAla-Gly-Glyの3通りがある。光学異性体を考慮した場合は、グリシン以外のアミノ酸は光学異性体をもち、異性体数が2倍になるので、光学異性体を考慮したGlyとGlyとAlaが結合したトリペプチドの異性体は3×2=6で6通りになる。
- 例2:
GlyとAlaとAlaが結合したトリペプチドの場合。(Alaが2分子。)
構造順はGly-Ala-Ala とAla-Gly-Alaと Ala-Ala-Gly の3通りがある。光学異性体を考慮した場合は、グリシン以外のアミノ酸は光学異性体をもち、異性体数が2倍になるのであった。そして、光学異性体を持つAlaが2個あるから、2×2=4で4倍になる。最終的に光学異性体を考慮した異性体数は3×4=12で12通りになる。
一次構造と高次構造
[編集]- 一次構造
タンパク質を構成するアミノ酸の配列順序のことを一次構造(いちじこうぞう、primary structure)という。たとえば表記「Gly-Gly-Ala」などは一次構造の表記である。
- 二次構造
- αヘリックス
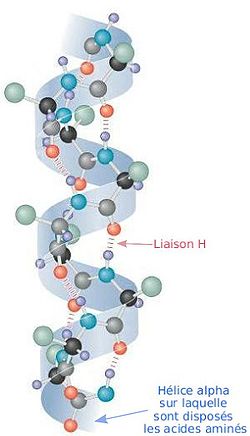
図中の“Liaison H”が水素結合のこと。
(リエゾン エイチと書いてある。)
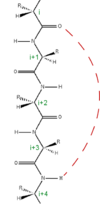
タンパク質のポリペプチドの多くの構造は、時計回り(右回り、Z
この螺旋化は、水素結合による現象であり、 アミノ酸の分子中の-C=Oと-N-Hの間のOとHが水素結合し、
-C=O ・・・ H-N-
のように水素結合した結果、ペプチド全体では螺旋構造を取る。
- βシート

並行にならんだ2本のポリペプチドの間に水素結合が保たれ、ヒダ状に折れ曲る構造をとることがあり、これをβシートという。
これら、αヘリックスやβシートをまとめて、タンパク質の二次構造(secondary structure)という。
- 三次構造

αヘリックスをとったポリペプチドや、βシートをとったポリペプチドなど、二次構造をとったポリペプチドが、さらに折りたたまれて三次構造(tertiary structure)になる。三次構造の形成には、側鎖どうしに働く引力や、システインによるジスルフィド結合(disulfide bond) -S-S- によるものが関わっている。
三次構造はサブユニットと呼ばれる。
三次構造の生体組織の例として、ミオグロビンがある。ミオグロビンは、1本のポリペプチド鎖からなり、ヘム色素を持っている。ヘム色素は、酸素と化合する性質がある。
- 四次構造

三次構造のポリペプチド鎖(サブユニットという)が、複数個あつまって集合体をなした構造を四次構造(quaternary structure)という。
四次構造の生体組織の例として、ヘモグロビンがある。ヘモグロビンは、2種類のサブユニットが2個ずつ、合計4個のサブユニットが集まって、できている。ヘモグロビンは、2個のヘム色素をもつ。
タンパク質の分類
[編集]単純タンパク質と複合タンパク質
[編集]タンパク質を加水分解したとき、アミノ酸だけでなく色素、核酸、リン、脂質などアミノ酸以外の有機物を生じるものを複合タンパク質(conjugated protein)という。 たとえば、血液中にふくまれるヘモグロビンは色素をふくむ複合タンパク質であり、牛乳にふくまれるガゼインはリン酸をふくむ複合タンパク質であり、唾液にふくまれるムチンは糖をふくむ複合タンパク質である。
いっぽう、タンパク質を加水分解したとき、アミノ酸のみを生じるものを単純タンパク質(simple protein)という。
球状タンパク質と繊維状タンパク質
[編集]タンパク質の形状にもとづいて、球状タンパク質(globular protein)と繊維状タンパク質(fibrous protein)に分類される。球状タンパク質は親水基が外側に向けて折りたたまれているので水に可溶であることが多い。それに対し、繊維状タンパク質はポリペプチド鎖がジスルフィド結合などで強固に結合した束になっているので水に難溶であることが多い。
アルブミン、グロブリン、グルテリンなどが、球状タンパク質である。
ケラチン、コラーゲン、フィブロインなどが、繊維状タンパク質である。
余談だが、コラーゲンを経口摂取してもアミノ酸に分解されるだけなので(しかもコラーゲンに再合成されることはない)、食べるコラーゲン美容にアミノ酸を摂る以上の意義はない。
タンパク質の特徴
[編集]- タンパク質の変性
タンパク質に熱、酸・塩基、重金属イオン、有機溶媒などを加えると立体構造が崩れて凝固・沈澱し生理的機能を失う。これをタンパク質の変性(denaturation)という。加熱によって変性することを熱変性という場合もある。
タンパク質の変性は、二次構造〜四次構造が破壊されることによって、起きている。そのため、変性したタンパク質は、元には戻らないのが普通である。タンパク質の変性では一次構造の配列順序は変わっていないが、二次構造以上の構造が変わっている。
- 溶液
タンパク質は水に溶けると、親水コロイド溶液になる。タンパク質のコロイド溶液は、多量の電解質によって、水和している水分子が取り除かれ、粒子がくっつき合い沈殿する(塩析)。
検出反応
[編集]ビウレット反応
[編集]
タンパク質水溶液に水酸化ナトリウム溶液NaOHを加え、少量の硫酸銅(II)水溶液CuSO4を加えると、赤紫色になる。この反応をビウレット反応(biulet reaction)という。これはCuとペプチド結合とが配位結合で錯イオンを形成することに基づき、トリペプチドやポリペプチドなどのようにペプチド結合を2個以上もつ場合に起こる。よって、ペプチド結合が1個だけであるジペプチドでは、ビウレット反応は起こらない。
キサントプロテイン反応
[編集]タンパク質水溶液に濃硝酸をくわえて加熱すると、チロシンやトリプトファンなどのアミノ酸中にベンゼン環をもつ場合に、タンパク質水溶液が黄色になる。これは、ベンゼン環がニトロ化されるためである。この溶液を冷却し、NaOHやアンモニアなどで溶液を塩基性にすると、橙色になる。 これらの反応をキサントプロテイン反応(Xanthoprotein reaction)という。
皮膚や爪に濃硝酸が付着したまま放置するとキサントプロテイン反応により黄色〜橙色に変色する。
橙色になった水溶液は中和すると、タンパク質の色は黄色に戻る。 フェニルアラニンはベンゼン環を持つが、あまり反応しない。
硫黄の検出反応
[編集]システインやメチオニンなどのようにタンパク質が硫黄を含む場合は、タンパク質の水溶液に、固体の水酸化ナトリウムを加えて加熱して、それから酢酸などで中和し、さらにそれから酢酸鉛(II)水溶液 (CH3COO)2Pb を加えると、硫化鉛(II) PbS の黒色沈澱を生じる。
窒素の検出反応
[編集]窒素を含む蛋白質水溶液に濃いNaOHaqを加えて加熱すると、アンモニアが発生する。この反応では、強塩基による弱塩基の遊離に近しいことが起こっている。アンモニアはリトマスや塩化水素で検出する。
毛髪のパーマネントのしくみ
[編集]毛髪はケラチンという繊維状タンパク質からなるが、この分子はジスルフィド結合 -S-S- によって、ところどころ結ばれている。このジスルフィド結合のため、毛髪は一定の形を保っている。
毛髪のパーマ処理は、還元剤をもちいて、このジスルフィド結合を還元して -S-H にすることで、ジスルフィド結合を切断している。
つぎに、酸化剤で、ジスルフィド結合 -S-S- を再生させると、もととは違ったつながりかたで、部分的にジスルフィド結合が再生されるので、元の髪型とは違った髪型になる。
パーマの還元剤には、チオグリコール酸アンモニウムが用いられる。パーマの酸化剤には、臭素酸ナトリウム NaBrO3 や過酸化水素などが用いられる。
繊維
[編集]繊維(fiber)とは、細くて糸状のものを指す。その中で、天然に存在する糸状の繊維を天然繊維(natural fiber)と呼び、石油などから合成した繊維を合成繊維(synthetic fiber)と呼ぶ。
天然繊維の中で、植物から得られるもの(例えば綿や麻など。主成分はセルロース)を植物繊維(plant fiber)と呼び、動物から得られるもの(羊毛や絹など。主成分はタンパク質。絹はカイコから得られる繊維)を動物繊維(animal fiber)と呼ぶ。
木綿
木綿(cotton)は植物のワタから取れる植物繊維で、主成分はセルロース。木綿の繊維は内部に中空部分があり、吸湿性が高い。
絹
絹はカイコガのまゆから取り出される繊維。主成分はフィブロインというタンパク質でセリシンというタンパク質に包まれている構造を持つ。
羊毛
羊毛の主成分はケラチン。羊毛は動物繊維で、表皮が鱗(うろこ)状で、クチクラ(キューティクル)と呼ばれる構造をしている。羊毛は伸縮性が大きく、水をはじく撥水性もあり、保温性があるので、毛布やコートなどに使われる。羊毛や絹はタンパク質なので、キサントプロテイン反応を示す。
化学繊維
[編集]合成繊維や天然繊維を溶媒に溶かしたり、化学反応させたりといった化学的な処理を行って作る繊維は、化学繊維という。天然繊維を溶媒に溶かしてから再び繊維に戻したものを再生繊維(regenerate fiber)と呼ぶ。セルロースの再生繊維はレーヨンと呼ばれ、ビスコースレーヨンと銅アンモニアレーヨンがある。
一方で、天然繊維を化学的に処理してその組成を変化させたものは半合成繊維という。半合成繊維の例としては、アセテート繊維がある。
酵素
[編集]ある種のタンパク質には触媒の働きを持つものがある。この触媒として機能するタンパク質を酵素(enzyme)という。酵素は、無機触媒や金属触媒とは、異なる性質をもつ。酵素は、ある特定の物質にしか作用しない。これを基質特異性(substrate specificity)という。そして酵素が作用する物質および分子構造を基質(substrate)という。
酵素には、基質と立体的にむすびつく活性部位(active site)があるため、このような反応が起こる。活性部位のことを、活性中心(active center)ともいう。

たとえば、唾液にふくまれるアミラーゼはデンプンを加水分解するが、タンパク質を加水分解できない。酵素インペルターゼはスクロースの加水分解にしか作用せず、マルトースやラクトースなどの他の二糖類にはインペルターゼは作用しない。また、マルターゼは、マルトースにしか作用しない。
失活
[編集]また、酵素はタンパク質であるので、タンパク質が変性する状況では、酵素はその能力を失う。熱変性などで、タンパク質が修復不可能になると、酵素の触媒能力もまた修復不可能となり、酵素を冷却しても、もはや触媒として機能しなくなる。このように酵素が触媒としての能力を失って、もはや酵素ではなくなったことを失活(deactivation)という。
実際には、100 ℃ 10分程度の加熱では失活しないこともある。
最適温度
[編集]酵素の触媒作用が最も働く温度を最適温度という。酵素にもよるが、動物の体温に近い、35℃から40℃といった温度である。
50℃以上など、これらより高温では熱変性で酵素の構造が破壊される。最適温度より低温にした場合は、低温の間は酵素としての作用が弱まるが、適温に戻すと、再び酵素としての触媒能力を取り戻す。 低温で酵素としての能力を失うことは一般には失活とは呼ばない。
最適pH
[編集]
酵素は、その場所のpHによって、触媒の働きの反応速度が変わる。もっとも酵素が働くpHを最適pH(optimum pH)という。
最適pHの値の傾向は、酵素の種類にもよるが、おおむねpH6~8といった、中性付近か、弱酸性の付近で、もっともよく働く。たとえばアミラーゼはpH6~7の付近が最適pHである。膵臓の中で働く酵素のトリプシンやリパーゼはpH8の弱い塩基性が最適pHである。
なお、胃酸の中で働く酵素のペプシンは最適pHが2の付近で胃液のpHに近い。このように、酵素は、その酵素が働く環境下に近いpHで、よく働く性質になっている場合が多い。
発展:酵素の反応速度
[編集](執筆中)
核酸
[編集]細胞には核酸という高分子化合物が存在し、これは遺伝情報を担っている。
リン酸、ペントース、有機塩基が結合した化合物をヌクレオチドという。

また、ペントースと有機塩基が結合した化合物をヌクレオシドという。
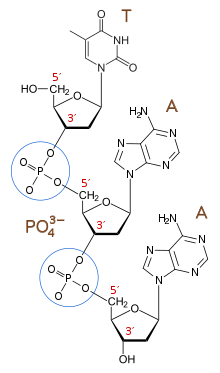
核酸はヌクレオチドのペントースの3位の -HO とリン酸の -OH の部分が縮合重合したポリヌクレオチドである。
核酸には、リボ核酸 RNA と デオキシリボ核酸 DNA の2種類が存在する。核酸を構成するペントースの部分が、RNAはリボース 、DNAはデオキシリボース である[2]。

有機塩基はプリン塩基とピリミジン塩基に分類される。
プリン塩基はアデニン(A)とグアニン(G)、ピリミジン塩基はシトシン(C)、チミン(T)、ウラシル(U)が該当する。
RNAを構成する有機塩基はアデニン(A)、グアニン(G)、シトシン(C)、ウラシル(U)の4種類である。DNAはアデニン(A)、グアニン(G)、シトシン(C)、チミン(T)の4種類である。

なお、アデニンとリボースが結合した物質をアデノシンといい、それにリン酸が一つ結合した物質をアデノシン一リン酸( AMP)、二つ結合した物質をアデノシン二リン酸(ADP)、三つ結合した物質をアデノシン三リン酸(ATP)という。つまり、生物基礎で習ったATPやADPもヌクレオチドなのである。リン酸同士が縮合している構造を高エネルギーリン酸結合というが、この結合が切れるときに放出されるエネルギーを用いて生体活動が行われている。
DNAの構造
[編集]
DNAはアデニン(A)とチミン(T)、グアニン(G)とシトシン(C)が水素結合によって、2本のポリヌクレオチドが合わさった二重螺旋構造をとっている。このように、有機塩基が特定の組み合わせで水素結合する性質を塩基の相補性という。RNAは一本鎖で存在しているため不安定である。後述の転写では、アデニン(A)にウラシル(U)が結合する。


DNAの働き
[編集]DNAの働きは、主にタンパク質の設計図となることと、遺伝情報を子孫に伝えることである。
DNAの遺伝子の働きかたを決める要因は、塩基の並び方で決定される。この塩基の並び方で、細胞で合成されるタンパク質が異なるため、DNAはタンパク質の設計図となっている。
DNAは、細胞核の中で、RNAをつくる(転写)。RNAの情報は、DNAの情報を元にしている。RNAは、核の外に出ていきリボソームと結合し、消化器官で食品のタンパク質から分解・吸収したアミノ酸を材料にして、 RNAの塩基配列に従ってアミノ酸をつなぎかえることで、タンパク質を作っている(翻訳)。
細胞が分裂して増殖するとき、DNAの二重螺旋が解けて部分的に一本鎖となる。この部分に相補対を作る塩基が次々と結合していくことによってヌクレオチドを形成し、元のDNAと全く同じ配列の二重螺旋構造が作られる(複製)。この過程で起こる複製ミスが、癌細胞の発生に繋がっている。







![{\displaystyle {\ce {[C6H7O2(OH)3]_{\it {n}}{+}3{\it {n}}\,HONO2->[(H2SO4)]{[C6H7O2(ONO2)3]_{\it {n}}{+}3{\it {n}}\,H2O}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ce8e592110ee8273ff948578f32870d30c61ba9)
![{\displaystyle {\ce {[C6H7O2(OH)3]_{\it {n}}{+}3{\it {n}}\,(CH3CO)2O->[(HNO3)]{[C6H7O2(OCOCH3)3]_{\it {n}}{+}3{\it {n}}\,CH3COOH}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba7a7ed3acbe2dc208c61313f22505ea66ea6b6f)

![{\displaystyle K_{1}={\frac {[A^{\pm }][H^{+}]}{[A^{+}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0368ba1dfb988cb44deb2f8909f2ed8a2ddfc1f2)

![{\displaystyle K_{2}={\frac {[A^{-}][H^{+}]}{[A^{\pm }]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a8e0579274e9d4aa31ad908f0d3c2d6336496065)
![{\displaystyle K_{1}K_{2}={\frac {[A^{-}][H^{+}]^{2}}{[A^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4e652de924ec79cf3450d5f76ed488eab8d7aa2b)
![{\displaystyle [A^{-}]=[A^{+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d88722f5ad8c296c4a4613385d6ac88a7e9fcb6)
![{\displaystyle K_{1}K_{2}=[H^{+}]^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ad7bd1f07041eeede2cb9f890814b150987a79ce)
![{\displaystyle -\log _{10}[H^{+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7d4facb0e2d2b0e304623a0149a32c7a9d80957e)











