中学校理科 第1分野/化学変化とイオン
酸性とアルカリ性
[編集]酸と酸性
[編集]
これまでに、塩酸(えんさん)や酢酸(さくさん)や硫酸(りゅうさん)などの酸について学んだ。これらの薄い水溶液は、つぎのような性質を示す。
- 青色リトマス紙を赤色に変える。
- BTB液を加えると赤色になる。
このような性質を酸性(さんせい)と言った。また、酸性を示す物質を酸(さん、acid)と言った。酸性の水溶液のこれらの性質の理由は、イオンの観点で見ると、実は水素イオンH+の性質である。したがって、酸とアルカリをイオンの観点から定義しなおすと次のようになる。
酸とは、水に溶けたときに水素イオン H+ を出す物質である。 たとえば塩化水素HClは、水溶液中では
- HCl → H+ + Cl-
と電離しているので、塩化水素は酸である。硫酸 H2SO4 も、同様に化学式に水素原子 H を含んでいる。この水素原子が水素イオンになるというわけである。
なお、「電離」(でんり)とは、水溶液に解けた時にイオンになる物質が、陽イオンと陰イオンに分かれることである。
アルカリとは、水に溶けたときに水酸化物イオン OH- を出す物質である。 たとえば水酸化ナトリウムNaOHは、水溶液中では
- NaOH → Na+ + OH-
と電離しているので、水酸化ナトリウムはアルカリである。
アンモニアNH3は、分子中にOHを含んでいないが、アンモニアの水溶液はアルカリ性をしめす。これは、アンモニアNH3は水に溶けると次のように電離して、水溶液中の水分子から水素イオンをうばってNH4+をつくり、水酸化物イオンOH-を発生させるためである。
- NH3+H2O → NH4++OH-
このように、ある物質が酸かアルカリか、または、どちらでもないかは、イオン反応式も知らなければ判断できないので注意が必要だ。 アンモニアの例からも分かるように、もし化学式中に水素原子Hを含んでいても、その水溶液が酸性とは限らない。
さて、つぎの節では、小学校以来これまでに習った酸とアルカリの基本的な性質を復習する。イオンの観点による酸やアルカリの定義と、これまでに習った酸やアルカリの基本的な性質や実験例、具体的な反応式などを関連付けてしっかり理解しよう。
酸とアルカリの復習
[編集]酸についての復習
[編集]酸性の溶液には次のような性質が有る。
- 食用に用いられる酢酸やクエン酸などの薄い水溶液を舐めてみると、すっぱい味がするように、食用の酸はすっぱいことが多い。
- (※ 注意:誤って、塩酸や硫酸などの水溶液を舐めてはいけない。)
- (※ 注意:理科室の物は、学校の先生の許可無く、味見しないこと。理科実験では危険な物質も扱うことがあるので、決して、許可無く口にいれてはならない。原則的に小中高の理科実験では、味見は行わない。たとえ食用で安全な物質だけを使う実験であっても、誤って別の危険な物質を混入させてしまう失敗をする場合もありうる。なので、理科実験では、念のため、最初から安全な物質でも味見をしないという指導が普通である。)
- 塩酸の水溶液は、鉄や亜鉛、マグネシウムなどの金属を溶かす。硫酸の水溶液は、金属と反応しやすい。
- 主な酸
おもな酸には、塩酸HCl、酢酸CH3COOH、炭酸H2CO3、硫酸(りゅうさん)H2SO4、硝酸(しょうさん)HNO3などがある。ミカンなどの柑橘類(かんきつるい)に含まれるクエン酸や、食用油などに含まれるオレイン酸も酸である。
- 塩酸 HCl
塩酸 HCl とは、塩化水素(えんかすいそ、hydrogen chloride)という気体が溶けた水溶液である。 無色透明の水溶液である。強い酸性を示す。
塩酸は、水溶液中で、次のようにイオンに電離している。
- HCl → H+ + Cl−
においは、刺激臭が有る。この刺激臭は塩化水素の蒸気のにおいである。
(※ 注意:塩酸のにおいをかぐ時は、決して直接、かいではいけない。塩酸の蒸気を手であおいだり鼻に風を送ったりして、間接的に、においをかぐ。)
- 塩酸は、マグネシウム、アルミニウム、亜鉛、鉄を溶かす。これらの金属を溶かすときに水素が発生する。この水素は塩化水素中に含まれていた水素原子が化学反応によって水素分子として生じたものである。
- 酢酸 CH3COOH
食用の酢酸水(CH3COOH水溶液)である食酢(しょくさく)には、酢酸(CH3COOH)が3%〜5%ほど含まれている。
酢酸は、水溶液中で、次のようにイオンに電離している。
- CH3COOH → CH3COO− + H+
においは、すっぱい刺激臭が有る。
濃い酢酸は、寒くなると凍る。凍った酢酸を氷酢酸(ひょうさくさん)という。
- 炭酸 H2CO3
二酸化炭素CO2の溶けた水溶液である。
- 硫酸 H2SO4
水溶液中では、つぎのように電離している。
- H2SO4 → 2H+ + SO42−
- 硫酸 → 水素イオン + 硫酸イオン
強い酸である。
- 硝酸 HNO3
水溶液中では
- HNO3 → H+ + NO3-
- 硝酸 → 水素イオン + 硝酸イオン
と電離し、強い酸性を示す。
- 強酸(きょうさん)と弱酸(じゃくさん)
塩酸や硫酸などの強い酸のことを、まとめて、強酸(きょうさん)という。
一方、炭酸や酢酸などの、弱い酸を、弱酸(じゃくさん)と言う。
- 実験の際の注意
塩酸や硫酸、硝酸などの強い酸は、危険であり、取り扱いには注意を要する。皮膚などにつかないように注意する。 もし、実験の失敗などで、これらの酸の濃い酸が体にかかったり、大量の酸がかかったら、実験を中断し、すぐに大量の純水で洗い、先生や大人に相談すること。
注意するのは、酸の液体だけでなく、酸の液体から発する蒸気なども、注意すること。蒸気を、かぎすぎないようにすること。また、目に入らないようにすること。
アルカリ
[編集]まず、復習をしよう。
水酸化ナトリウム水溶液や水酸化カルシウム水溶液やアンモニア水溶液は、つぎのような性質を示す。
- 赤色リトマス紙を青色に変える。
- BTB液を加えると青色になる。
- 水溶液にフェノールフタレイン溶液を加えると、赤色に変わる。
このような性質をアルカリ性と言う。(または「塩基性」(えんきせい)と言う。高校では「塩基性」のほうの呼び方を使う。中学の段階では、アルカリ性で呼び方を統一してよい。)また、水溶液がアルカリ性を示す物質のことをアルカリ(alkali、発音:アルカライ)といい、高校では、そのような物質を「塩基」(base , ベイス)と呼ぶ。
アルカリの中にはタンパク質や脂肪などを溶かすものもあり、皮膚などを溶かし、強いアルカリや濃いアルカリの中には危険な物もある。取り扱いには注意すること。皮膚などにアルカリをつけないようにする。もしアルカリが目に入った場合は、即座に大量の純水で洗い流し、先生や大人に相談および連絡をして、必要に応じて保険医などに診察してもらうこと。
注意するのは、アルカリの液体だけでなく、アルカリの液体から発する蒸気なども、注意すること。蒸気を、かぎすぎないようにすること。また、目に入らないようにすること。
こういう目にアルカリの入る事故が起きないように、あらかじめ、安全メガネなどを掛けておくなど、必要に応じて準備すること。
- 主なアルカリ
- 水酸化ナトリウム NaOH
水酸化ナトリウム(すいさんかナトリウム、sodium hydroxide、ソウディアム・ハイドロオキサイド)は、強いアルカリ性を示す。なので取り扱いには気をつけること。
- 白色で半透明の固体である。
- 空気中に放置しておくと、空気中の水分を吸収し溶ける。この現象を「潮解」(ちょうかい,deliquescence,デリクエーセンス)といい、また、この性質を潮解性という。このため、水酸化ナトリウムを取り出すときは手際よく行う必要がある。
- アルミニウムを溶かす性質が有る。
- 強いアルカリ性のため、タンパク質や脂肪などを溶かす。
- 水酸化カルシウム
消石灰のことである。
- 白色の固体である。
- 水には溶けにくいものの、溶ける。水酸化カルシウムの水溶液を石灰水(せっかいすい、limewater、ライムウォータ)という。
- 石灰水に二酸化炭素を吹き込むと、白い沈殿物が生じる。この現象はよく、気体の種類が二酸化炭素であるかどうかを調べる手法に利用される。
- アンモニア NH3
アンモニアの水溶液をアンモニア水(アンモニアすい)という。
- 刺激臭が有る。
- 水酸化カリウム KOH
水酸化カリウムは、次のように電離する。
- KOH → K+ + OH-
中性
[編集]酸性でもなく、アルカリ性でもない性質を中性(ちゅうせい)という。純水(じゅんすい)は、中性である。 水溶液が中性をしめす物質は多くあるが、例を上げると、食塩水や砂糖水は中性である。リトマス紙に中性の水溶液をつけても、色は変わらない。
イオンの観点から見れば、水溶液が中性の物質は、たとえば、
- 塩化ナトリウムNaClのように水溶液で電離はするが、水素イオンや水酸化物イオンOHをふくまない物質。
- 砂糖のように、そもそも電離しなくて、イオンにならない物質。
- 純水 H2O のように、水素イオン H+ の数と、水酸化物イオン OH- の数とが、つりあっている物質。
などがある。
中和
[編集]酸性の溶液とアルカリ性の溶液を混ぜた水溶液を作ると、酸の水素イオンと、アルカリの水酸化物イオンが結合し、水分子H2Oが出来る。 この反応を中和(ちゅうわ)と呼ぶ。
- H+ + OH− → H2O
酸とアルカリが中和した際には水が生じる。
また、中和の結果、その水溶液は中性に近づく。中和とは、酸とアルカリが反応して水を生じることを言うので、必ずしも水溶液は中性ではない。
具体例として、塩酸 HCl と水酸化ナトリウム NaOH との、中和を考える。
- H+ +Cl− + Na+ + OH− → H2O + Na+ + Cl−
のような反応が起こる。 (左辺前半の H+ +Cl− はHClに由来。左辺後半の Na+ + OH− は NaOH に由来。)
中和をしただけだと、水溶液にNaClが溶けて電離したままなので、塩化ナトリウム NaCl は 出来ない。
塩化ナトリウム NaCl のように、分子式が、酸とアルカリの中和で作れる分子になってる化合物を、塩(えん)と言う。
つまり、
- 酸 + アルカリ → 水 + 塩
である。
たとえ塩化ナトリウムや塩化物で無くとも、もし酸とアルカリの中和反応で出来る化合物なら、その化合物は塩(えん)と言う。
塩の定義を、より詳しく言うと、中和反応での、酸の陰イオンと、アルカリの陽イオンとが結びついた化合物を、塩(えん)という。
詳しい定義で、たとえばNaClを説明すると、
- 「酸(HCl)の陰イオン(Cl−)と、アルカリ(NaOH)の陽イオン(Na+)とが結びついた化合物を、塩(NaCl)という。」
というふうに、確かに、塩(えん)に なっている。
塩酸の水溶液に、水酸化ナトリウムを加えていくと、中和によって、だんだん中性に水溶液は近づいていく。
そのまま、さらに水酸化ナトリウムを加えると、もし完全にピッタリと塩酸の水素イオンを打ち消してつりあった瞬間では、水溶液は中性になるが、しかし現実には、ピッタリとつりあった瞬間で止めるのは不可能なので、よって基本的には、やや酸性よりの時点で実験を止めるか、それとも、ややアルカリ性に行き過ぎた時点で、実験を止めることになる。
つまり、けっして、
「ピッタリと中性になった時点で、水溶液を安定させて、もしそれ以上のアルカリまたは酸が外部から加えられてても、それ以上の反応の進行をとめるて中性のままで、いつづける」ような仕組みは無い。
なので、上述のように、完全に中和して中性になった水溶液に、そのあと少し余分に水酸化ナトリウムを加えられて、ややアルカリ性になった状態で、実験を終えることになるのが普通だろうか。
中和で生じる塩の種類については、反応に用いた酸とアルカリによって生じる塩が決まる。例えば、塩酸とアンモニア水が反応した時には水と塩化アンモニウム(えんかアンモニウム、ammonium chloride)が生じる。この反応は次の化学反応式で書かれる。
以上の例のように、酸とアルカリを混合すると、中和によって、水と塩(えん)が生じる。
- おもな塩
・塩化ナトリウム(食塩) NaCl
中和によって塩化ナトリウムを生じさせたい場合は、塩酸HClと水酸化ナトリウムNaOHの中和で、塩化ナトリウムNaClを生じさせる事が出来る。
・硫酸バリウム BaSO4
硫酸 H2SO4 と水酸化バリウム Ba(OH)2 の中和によって、塩(えん)として、硫酸バリウム BaSO4 が生じる。
- H2SO4 + Ba(OH)2 → BaSO4 + 2H2O
- 硫酸 + 水酸化バリウム → 硫酸バリウム + 水
硫酸バリウムは白色であり、また、沈殿(ちんでん)を生じる。つまり、硫酸バリウムは白色の沈殿になる。
したがって、硫酸と水酸化バリウムの中和で、白色の沈殿が生じる。この、硫酸と水酸化バリウムの中和で生じた白色の沈殿が、硫酸バリウムである。
反応式を書くときは、塩だけでなく、水も生じることを忘れないように。
なお、硫酸バリウムは、医療用の放射線検査でもちいる造影剤(ぞうえいざい)である。
・炭酸カルシウム CaCO3
白色の沈殿である。石灰水を白く濁らせるのは、この炭酸カルシウム である。
炭酸と、水酸化カルシウム水溶液との、中和で炭酸カルシウム CaCO3 が生じる。
- H2CO3 + Ca(OH)2 → CaCO4 + 2H2O
- 炭酸 + 水酸化カルシウム → 炭酸カルシウム + 水
・塩化カルシウム CaCl2
塩酸 HCl と 水酸化カルシウム Ca(OH)2 の中和で、塩化カルシウム CaCl2 が生じる。
・硝酸カルシウム Ca(NO3)2
硝酸 HNO3 と 水酸化カルシウム Ca(OH)2 の中和で生じる。
- 2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
- 硝酸 + 水酸化カルシウム → 硝酸カルシウム + 水
沈殿は生じない。水溶液から硝酸カルシウムを取り出す場合は、蒸発や再結晶などによって取り出す。
以上の塩の例のように、塩には、NaClのように水に溶けやすい塩と、硫酸バリウム BaSO4のように水に溶けにくい塩との、2種類がある。
PH
[編集]水溶液中での酸性やアルカリ性には強さがある。酸性やアルカリ性の強さを決める要因は、おもに、その酸の種類またはアルカリの種類と、水溶液中での酸またはアルカリの濃度で決まる。
水溶液の酸性やアルカリ性の強さを表す値を pH(ピーエイチ、もしくはペーハー) と呼ぶ。pH が、 pH=7のとき、その溶液は中性である。
pHが7未満が酸性である。pHが小さくなるほど、溶液は酸性に近づく。
一般に、pH=0 で最も強い酸性である。
またpHが7より大きいと、アルカリ性である。pHが大きくなるほど、溶液はアルカリ性に近づく。一般に、pH=14が最も強いアルカリ性である。
pHは普通、0から14の範囲内である。
私たち中学3年以上の読者は、イオンを知っているし、酸は水素イオン H+ によって出来ることも知っているし、アルカリは水酸化物イオン OH- などによって出来ることも知っている。
つまり、PHの強さは、水溶液中の水素イオンや水酸化物イオンの数や濃度から、計算することができる。( PHとイオンの数の計算は、くわしくは、高校で習う。 )
pH は、一定量を加えたときに電離したときの水素イオン濃度をもとに、値が決められています。(受験研究社)
酸は、どんな酸でも、水溶液中で電離したときに
水素イオン H+ が発生します。
なので、水素イオン濃度 をもとに決める方法で、ほとんどの酸の強さを決められます。
- (※ もしかしたら、ごく例外的な酸で、pHが中性に近いのに反応のつよい酸などもあるかもしれないが、しかし中学高校では扱わないので、そういう例外的な物質は考えないでおく。)
同様に、すべてのアルカリは、水溶液中で電離したときに OH− を発生します。
この OH− の影響で、もとあった水にふくまれていた H+ がうばわれます。
なので、水溶液全体の水素イオン H+ の濃度を調べる方法で、
酸の強さもアルカリの強さも、両方とも分かる、という仕組みなわけです。
なので、pH のことを「水素イオン指数」とも言います(受験研究社)。
ただし、一般的には pH (ピーエイチ、ペーハー)の呼び方が普及しています。
- ※ 詳しくは、高校で習います。中学では、ここまで知っておけば、もう十分でしょう。
pH指示薬
[編集]物質の中には、水溶液に接触させた時に、水溶液のpHの値によって色が変化するものがある。このような物質はpHを調べるのに用いることができるので、これらの物質のうちpHを調べる物質として実用化されている物質をpH指示薬(pH indicator、ピーエイチ・インディケイター)という。いわゆるリトマス試験紙もpH指示薬に含まれる。またリトマス試験紙のように、pH指示薬を試験用の紙に染み込ませて用いる事が多い。このようなpH指示薬を染み込ませてある紙をpH試験紙(pH indicator paper)という。
リトマス紙やBTB溶液やフェノールフタレイン溶液は、pH指示薬である。pH指示薬には、他にもメチルオレンジなどがある。
pH指示薬は、その物質によって、色を変えるpHの範囲が限られている。たとえば、メチルオレンジはpH=3.1以下では赤色で、そこからpHが高くなると黄色味を増していき、pH=4.4では橙黄色である。pH=4.4より高いpHでは橙黄色のまま、ほとんど色が同じなので、このpHの範囲では指示薬として用いられない。 なお、このように指示薬の色が変わるpHの範囲を変色域(へんしょくいき、indicator range など)という。
水溶液とイオン
[編集]水溶液の電気伝導性
[編集]電解質
[編集]水に溶かしたとき、その水溶液に電流が流れるようになる物質を
- 例) 塩化ナトリウム(食塩)、水酸化ナトリウム、塩化銅、硫酸、塩化水素(塩酸) など。
水にとかしてもその水溶液に電流が流れない物質を
- 例) エタノール、砂糖、など。
塩化ナトリウムであっても、水溶液に溶かしていない、固体の塩化ナトリウムでは、たとえ電気回路に電圧を加えても、電気を流さない。水酸化ナトリウムも同様に、水溶液に溶かしていない固体の水酸化ナトリウムは電気を流さない。
塩化銅も、固体の状態では、電圧を加えても、電気を流さない。
水の電気分解の実験を思い出そう。純粋な水そのものは電気を通さないので、少量の水酸化ナトリウムを加えた。
水酸化ナトリウムは、電解質である。なので、ツジツマが合っている。
いっぽう、砂糖は、水に溶かしても(砂糖水にしても)電流が流れない。この事は、砂糖が非電解質であることと、ツジツマが合っている。
塩化銅の水溶液に電気を流す実験
[編集]塩化銅の水溶液に電気を流すため、水溶液にプラスの陽極とマイナスの陰極の電極を差し込んで電気を流すという実験について、これから説明する。
この塩化銅水溶液に電気を流す実験では、陰極に、銅が付着する。一方、陽極付近には、塩素が気体として発生する。
発生気体が塩素であることは、
実験をするときは、換気をして、実験すること。
この陽極と陰極のそれぞれの発生物質から、塩化銅の水溶液では、塩素と銅という二つの物質に分かれている事が、予想される。 電気を流していない状態では、二つに分かれた塩素と銅は、水溶液に溶けている状態だが、電気を流すことで、出てきた、という仕組みが予想される。
電気は、プラスとマイナスが、引き寄せあうのだった。
陰極に銅が付着するということは、水溶液中の銅は、逆の電荷を持っているということであり、つまり銅はプラスの電荷を持っているということである。
一方、陽極に塩素が発生するという事は、つまり塩素は逆符号の電気を持っている、つまり塩素はマイナスの電気を持っているということである。
そのほかの様々な実験からも、塩化銅の水溶液中での、電気を流す前の塩素は、マイナスの電気を持っていることが確認されている。中学生は、この実験結果を、うのみにして良い。水溶液中の銅についても、塩化銅の水溶液の中では、電気を流す前の銅は、プラスの電気を持っていることが確認されている。
さて、普通の水に少量の食塩などを混ぜて電気を流すと、水の電気分解によって、水素と酸素が発生する。
今回の塩化銅の水溶液に、電気を流して、銅と塩素を発生させる実験は、つまり、塩化銅の電気分解(電解)をしたことになる。
なお、この実験で陰極に銅が付着することを応用して、金属の表面に 銅めっき をすることが出来る。
銅の電解精錬
[編集]
銅の純度が20%から40%の銅精鉱を、コークス(主成分:炭素)などとの加熱反応で還元したものは、銅の純度が約99%であり、
電解液には硫酸銅(II)水溶液を用いる。陽極(英語: anode、アノード)には、純度を上げたい粗銅を使用する。一方、陰極(英語: cathode、カソード)には純度の高い銅を用いる。電気分解により、以下の反応が起こる:
- 陰極: Cu2+ + 2e- → Cu
- 陽極: Cu → Cu2+ + 2e-
陽極からは銅だけでなく、銅よりイオン化傾向の大きい鉄、亜鉛、ニッケルなども溶け出す。しかし、陰極で析出するのはほぼ銅のみであるため、高純度の銅が得られる仕組みとなっている。
粗銅中に銀や金が含まれていた場合、これらはイオン化傾向が銅よりも小さいため、陽極の下に沈殿する。この沈殿物を
陰極には純度99.99%程度の高純度銅が析出する。これを
塩化水素の水溶液に電気を流す場合
[編集]他の電解質の水溶液に、電気を流す場合も考えてみよう。
塩酸の水溶液に電気を流すと、陽極に塩素が発生する。塩化銅の水溶液に電気を流す実験でも、陽極には、塩素が発生したのであった。以上の2つの実験から、塩素をふくむ電解質の水溶液の陽極には、ふつう、塩素が発生することがわかる。
一方、塩酸の水溶液に電気を流す実験で、陰極(マイナス極)のほうには、水素が発生する。
- 水素が陰極に引かれることから、水素は逆の電気を持っている、つまり水素はプラスの電気を持っている。
- 塩素が陽極に引かれることから、つまり塩素の電気は逆符号の電気であり、塩素はマイナスの電気を持っている。
そのほかの様々な実験からも、塩酸や塩化銅の水溶液中での塩素は、マイナスの電気を持っていることが確認されている。中学生は、この実験結果を、うのみにして良い。
原子の成り立ちとイオン
[編集]原子は,
陽子の質量と、中性子の質量は、同じである。厳密にいうと、ほんのわずかに質量が違うのだが、ほとんど同じなので、中学の段階では、陽子の質量と、中性子の質量は同じである、と考えてよい。一方、電子の質量は、陽子と比べて、極めて小さい。電子の質量は、陽子の質量の 約 倍 でしかない。
したがって、原子にとって、電子は、ほとんど質量が無い。ある原子や分子の質量の大きさを決めているのは、その原子核の陽子や中性子の個数である、と考えても、中学高校では、あまり問題は無い。
電子1個のマイナスの電気の強さは、陽子1個のプラスの電気の強さと符号が反対なだけで、強さは同じであるので、1個の電子と1個の陽子の力がつりあう。
原子の中心には+の電気をもつ原子核が1つあり、マイナスの電気をもついくつかの電子がそれを取り巻いている。安定している状態の原子や分子では、原子核の持つ陽子の数と、電子の持つ数とは、同じであり、原子核がもつ+の電気の総量と、電子のもつマイナスの電気の総量が等しいので、原子全体は電気を帯びていない。
ある原子が、何の元素であるかは、原子核に含まれる陽子の数で決まる。一方で、原子核の中性子の数は、陽子の数に近いが、必ずしも陽子と中性子の数が同じとは限らない。原子核に含まれる陽子の数が同じで(すなわち、同じ元素で)、中性子の数が異なるものを、
ふつうの水素原子の原子核は、1個の陽子だけである。1個の陽子だけを持つ水素原子のまわりの電子の数は、1個の電子がある。
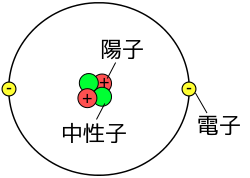
ふつうのヘリウム原子の原子核は、2個の陽子と、2個の中性子との、計4個の粒子である。ヘリウムの電子の数は、陽子と同じ2個である。
ヘリウム原子の原子核の質量は、水素原子の原子核の質量の、ほぼ4倍である。
たとえば水素原子とヘリウム原子の質量の比なら、電子の質量は無視できる。よって原子核の粒子数の比から、ヘリウム原子の質量は、水素原子の質量の4倍である。
電気を帯びた原子をイオンという。イオンのうち、+(プラス)の電気を帯びたイオンを陽イオンと言い、いっぽう、-(マイナス)の電気を帯びたイオンを陰イオンという。
塩化銅の水溶液での塩素は、陰イオンである。塩化水素の水溶液での塩素も、陰イオンである。
塩化銅の水溶液での銅は、陽イオンである。塩化水素の水溶液での水素は、陽イオンである。
イオンは原子が電子を失ったり受けとったりすることにより、安定な状態になったものである。陽イオンは、原子が電子を失って+の電気を帯びたものである。電子を2個失うと、1個の場合の2倍の+電気を帯びる。一方、塩素原子などは電子を受けとり-の電気を帯びる。
原子の記号の右肩に,帯びている電気の種類と量を書いた記号をイオン式という。
(注:イオン式という用語は、令和2年度教科書から全ての教科書で撤廃されました。)
- 水素イオン(H+) …… 水素原子が電子を1個失った陽イオン
- 銅イオン(Cu2+) …… 銅原子が電子2個を失った陽イオン
- カリウム イオン (K+)
- 亜鉛イオン(Zn2+)
- ナトリウムイオン(Na+)
- 塩化物イオン(Cl-) …… 塩素原子が電子1個を取りこんだ陰イオン
- 水酸化物イオン(OH-)のように、イオンには原子がいくつか集まったもので電気を帯びたものもある。
- 硫酸イオン(SO42-)
- 硝酸イオン(NO3-)
OHなど、いくつかの原子があつまった物であるが、分子にはなっていないものを、原子の集まりという意味で、原子団(げんしだん)と言う。
アンモニウムイオンも、このような、いくつかの原子があつまったイオンであり、アンモニウムイオンは原子団である。
ナトリウムイオンは陽イオンであり、Na+である。
塩化ナトリウム NaCl では、塩化物イオンCl-のマイナス電荷1個と、ナトリウムイオンNa+とのプラス電荷1個がつりあっているので、塩化ナトリウム NaCl 全体では電気を持っていない。
- NaCl → Na+ + Cl-
塩化銅 CuCl2 も、塩化物イオン Cl- の2個と、銅イオン1個 Cu2+ のプラス電荷の2個がつりあっているので(銅イオンの場合、銅原子1個につき電気が2個ある)、塩化銅 CuCl2全体では電気を持っていない。
- CuCl → Cu2+ + 2Cl-
電解質が水にとけて陽イオンと陰イオンとに分かれることを
砂糖が水に溶けても、電離はしていない。エタノールを水に溶かしても、電離してない。
塩化水素は、気体の状態では水素原子と塩素原子が結合したもので電気的に中性である。水にとけると、水素イオンH+と塩化物イオンCl-となる。1つの塩化水素からは1つの水素イオンと1つの塩化物イオンができる。
- HCl → H+ + Cl-
- さまざまな電解質の電離の例
・塩化水素
- HCl → H+ + Cl-
・塩化ナトリウム
- NaCl → Na+ + Cl-
・水酸化ナトリウム
- NaOH → Na+ + OH-
・塩化銅
- CuCl2 → Cu2+ + 2Cl-
参考: 人体とイオン
[編集]スポーツドリンクなどの広告とかで、「電解質」やら「イオン」などの文字を見たり聞いたりすることもあるでしょう。保健体育などの授業でも、電解質やイオンなどの言葉を聞く場合もあるかもしれません。
これは、どういうことでしょうか。
じつは、私たち人間の体にも、血液中などに、塩化物イオンやナトリウムイオンなどのイオンが溶けています。
ナトリウムイオンは、人体で、さまざまな働きをしています。汗をかくと、ナトリウムイオンなどのイオンが失われます。もしナトリウムが不足しすぎると、 めまい や けいれん などの危険な症状になります。
なので、ナトリウムイオンなどをおぎなうために、食事などでは
学校の給食は、栄養士の人などが、中学生に必要な塩分やカロリーやビタミンなどを計算して、給食を作っています。アレルギーが無い限り、なるべく給食を食べるようにしましょう。
さて、汗をたくさん、かいたあとに、水だけを飲んでも、ナトリウムは補われません。熱中症で、汗をかきすぎた場合は、患者に水だけを飲ませるよりも、うすめの食塩水をのませたほうが良いのです。(中学高校の保健体育の教科書でも、そう説明されています。)ちなみに、みそ汁の濃度と同じくらいの濃度が、熱中症の人に飲ませる食塩水の濃度では、ちょうど良いとされています。この濃度は、水1kgあたり、食塩2gていどです。
スポーツドリンクで「イオン」とか「電解質」と言ってるのは、商品にもよりますが、運動で汗をかいたときに不足しやすいナトリウムなどのイオンが含まれている飲料だからです。
電池のしくみ
[編集]化学変化や温度差、光などの作用によって電気エネルギーをつくり出す装置を
本節では、化学電池を重点的に説明する。イオンの観点から、化学電池を説明する。
さて、化学電池では、どうやって、化学変化で電気を起こしているのだろうか。
- 復習:電気回路とは
まず、電気回路について、復習の便宜のため、説明しておこう。 まず電流とは、導線の内部を、マイナスの電気をもつ電子が流れているのが電流の正体である。
金属線を電池などの電源に接続すると、金属線中の電子は-極から+極に向かっていっせいに移動する。回路を流れている電流とは、このように電源の-極から+極に流れる電子の移動である。
電流の向きは電源の+極から出て-極に入る向きに流れると決められている。これは、電流の向きが決められた当時は電子がまだ発見されていなかったことによる。電流の正体が-の電気をもつ電子の流れであることがわかってからも、「電流は電源の+極から出て、-極に入る向きに流れるもの」と定義されている。
参考:電池の発見の歴史
[編集]
1780年ごろ、イタリアの解剖学者ガルバーニ(1737〜1798)は、解剖したカエルの あし に2種類の金属を接触させると、あしが感電したかのようにけいれんすることを発見した。ガルバーニはカエルの筋肉に電気がたくわえられているのだろうと考え、これを「動物電気」と名づけた。
しかし、解剖した あし が けいれん する本当の原因は、2種類の金属が、電池の電極となって、電気をつくっているのだった。 イタリアのボルタ(1745〜1827)による電池の研究によって、けいれんの本当の原因が明らかになった。
そしてボルタは、1800年、2種類の金属(銅と亜鉛)で、食塩水(塩化ナトリウム水溶液)でしめらせた厚紙をはさんだ物によって電池をつくり、現代でいう「ボルタの電池」を発明した。

この電池から取り出される電流は小さかったので、ボルタは直列的に2種類の金属ではさんだ厚紙(食塩水でしめらせてある)を何段も積みかさね、柱状にした電池を発明した。この柱状に積み重なったボルタの電池を「ボルタの電椎」(でんつい)という。
ボルタの電池
[編集]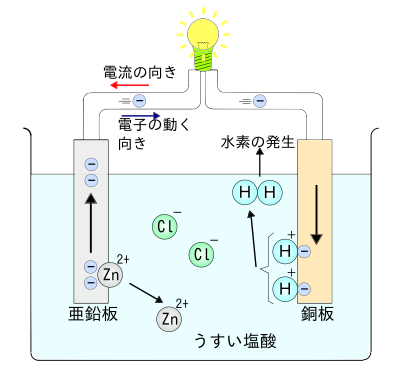
うすい塩酸、またはうすい硫酸に、亜鉛板と銅板をひたすと、電池が作れる。銅板の側が電池の正極で、亜鉛板の側が負極である。このように、亜鉛板と銅板と酸溶液からなる電池をボルタの電池(Voltaic pile)という。
亜鉛板が電池のマイナス極に相当し、銅板がプラス極に相当する。
ここで重要なのは、決して片方の亜鉛板だけを硫酸にひたしても、マイナス極しか出来ていないから、電気は発生しなくて、電池にはならない。たとえ亜鉛板が酸と反応して溶けても、電池は出来ず、電気も流れず、単に亜鉛板が硫酸にとけていくだけである。
マイナス極の亜鉛板だけでなく、亜鉛板にくわえて、プラス極になる銅板を薄い硫酸にひたして、こうしてプラス極とマイナス極とがそろって、化学電池になるのである。
ボルタの電池が、電池であることを確認するには、回路に豆電球(ただし理科実験用の小型のもの)をつないだり、あるいはモータ(ただし理科実験用の小型のもの)をつなげば良い。回路に電球やモータをつないだとき、電極で起こる化学反応は以下の通りである。
- 亜鉛板
亜鉛原子が電子を2個失って亜鉛イオン(Zn2+)になり水溶液にとけ出す。
- Zn → Zn2+ + 2e-
ここで、記号 e は電子である。電子は、当然、マイナスの電気を持っているので、e-という記号になる。 電子e-は、導線を伝わって、亜鉛板から銅板のほうへと流れていく。
- 銅板
亜鉛板にたまった電子が導線へ流れ出し、モーターを通ったあと銅板に流れこむ。この電子は、水溶液中の水素イオン(H+)と結びつき水素原子になる。できた水素原子2個が結びついて水素分子()になる。
電子の流れは「亜鉛板 → 銅板」なので、電流の向きは、「銅板 → 亜鉛板」となり、亜鉛板が−極、銅板が+極となる。
ボルタの電池の電圧は、最初は常にほぼ一定である。この電池が作る電圧を
なお、ボルタの電池は、時間がたつと、起電力が下がっていってしまう。これは反応中に銅板で発生する水素による泡が原因である。
このような電極に発生した泡による起電力の低下を、電池の
ボルタの電池のように、プラス極の金属板とマイナス極の金属板は、べつの種類の元素でなければならない。
プラス極とマイナス極の両方の金属板を亜鉛板にして、塩酸など酸溶液にひたしても、まったく電気は流れない。
同様に、プラス極とマイナス極の両方の金属板を銅板にして、塩酸など酸溶液にひたしても、まったく電気は流れない。
ボルタの電池の他にも、化学反応を用いた電池は多くある。たとえば、乾電池に用いられるアルカリ電池やマンガン乾電池も、化学反応を用いている。
このように、起電力の電圧の発生要因に化学反応を用いている電池を化学電池(かがくでんち)という。
金属と酸との化学電池の組み合わせは、銅と亜鉛だけでなくとも、可能である。
銅板とマグネシウムリボンでも、塩酸の水溶液で、電池は出来る。
亜鉛板とマグネシウムリボンでも、塩酸の水溶液で、電池は出来る。
イオン化傾向
[編集]- (※くわしくは高校でイオン化傾向を習うが、中学の検定教科書と参考書などに書かれているので、余裕があれば学んで頂きたい。)
ボルタ電池や、後述するダニエル電池のような反応がなぜ起こるかは、この節で説明する、亜鉛板と銅板との「イオン化傾向」というものの差による。
金属元素の単体を水または水溶液に入れたときの、陽イオンのなりやすさを
例として、亜鉛Znを
- Zn + 2H+ → Zn2+ + H2
一方、銀Agを希塩酸(薄い塩酸のこと)に入れても反応は起こらない。 このように金属のイオン化傾向(陽イオンのなりやすさ)の大きさは、物質ごとにイオン化傾向の大きさが異なる。
今度は、銅を希塩酸の溶液に入れてみた場合を考える。この場合は、なにも反応しない。 以上の例だけでは、まだ、銅と銀のイオン化傾向の大きさの大小関係は不明である。
- 銅と銀のイオン化傾向
- 硝酸銀溶液と銅の場合
そこで、銅と銀のイオン化傾向(陽イオンのなりやすさのこと)を比べるための実験例として、
硝酸銀AgNO3の溶液に、銅線や銅板などの銅の固体を添加する。
ここでは、銅板を添加したとしよう。すると、銅板の表面に銀が付着し、銀が析出する。 一方、この硝酸銀の溶液中では銅板は陽イオンとなり溶ける。 溶液は、しだいに青くなるが、この青色は銅イオン溶液の色である。以上の変化を反応式で書くと、
- Cu + 2Ag+ → Cu 2+ + 2Ag
なお、この反応で生じた銀を、生じ方が樹木が伸びるように析出した銀が伸びることから
- 硫酸銅溶液と銀の場合
いっぽう、今度は溶液を変え、硫酸銅 H2SO4 の溶液に銀板Agをいれても、 なにも析出せず、なにも変化は起きない。
これらのことから、銅は銀よりもイオン化傾向(陽イオンのなりやすさのこと)が大きいであろうことが予測できる。
- 亜鉛と銅のイオン化傾向
また溶液を変え、硫酸銅の水溶液に亜鉛板Znを添加すると、亜鉛の表面に銅が析出する。 このことから、亜鉛Znは銅Cuよりもイオン化傾向が大きいことが予想できる。
- イオン化列(イオンか れつ)
さまざまな溶液や金属の組み合わせで、イオン化傾向の比較の実験を行った結果、 イオン化傾向の大きさが決定された。 左から順に、イオン化傾向の大きい金属を並べると、以下のようになる。
- Li > K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > (H2) > Cu > Hg > Ag > Pt > Au
- 左側ほど、陽イオンになりやすい。 右側ほど、イオン化しづらい。
(中学の段階では、覚える必要はない。)
金属を、イオン化傾向の大きさの順に並べたものを金属の
水素や水は金属では無いが、比較のため、イオン化列に加えられる。
金属原子は、上記の他にもあるが、高校化学では上記の金属のみのイオン化列を用いることが多い。
なお、イオン化列の記憶のための語呂合わせとして、
「リッチに貸そうかな、まあ、あてにすな、ひどすぎる借金。」(りっちに かそうかな、まあ、あてにすな、ひどすぎる しゃっきん。)
などのような語呂合わせがある。ちなみにこの語呂合わせの場合、
- 「Liリッチ に Kか そう かCa なNa、まMg あAl、あZn てFe にNi す なPb、ひH2 どCu すHg ぎAg る 借金Pt,Au。」
と対応している。中学では無理に覚える必要はない。
ダニエル電池
[編集]

この図での「カチオン」
とはZn2+ のこと。「アニオン」とはSO42- のこと。 ※ 中学生用の説明図がまだ作成されていません。検定教科書や市販の教材で、図をご確認ください。 アノードとは、電池のマイナス極のこと。カソードとは電池のプラス極のこと。
- (※編集者への注意。 2021年の指導要領改訂により、従来のボルタ電池に加えて、ダニエル電池を中学で習うようになった。また、イオン化列もより詳しく習うようになった。)
ビーカーをセロハンまたは素焼きの筒・板で区切り、どちらかに硫酸銅水溶液に銅板、もう一方に硫酸亜鉛水溶液に亜鉛版をひたすと、電池が作れる。銅板の側が電池の+極で、亜鉛板の側が-極である。このように、亜鉛板と銅板と酸溶液、セロハンまたは素焼きの板からなる電池をダニエル電池という。
- 亜鉛板側
亜鉛原子が電子を2個失って亜鉛イオンになり水溶液にとけ出す。なので亜鉛イオンはとけてボロボロになっていく。
- Zn → Zn2+ + 2e-
- 亜鉛(原子) → 亜鉛イオン + 電子(2個)
ここで、記号 e は電子である。電子は、当然、マイナスの電気を持っているので、e-という記号になる。 電子e-は、導線を伝わって、亜鉛板から銅板のほうへと流れていく。
亜鉛イオンが溶けだすことにより硫酸亜鉛水溶液内のイオンの濃度は濃くなっていく。
- 銅板側
亜鉛版側から流れてきた電子e-は硫酸銅水溶液中の銅イオンとくっつき、銅原子となり銅板に付着する。
- Cu2+ + 2e- → Cu
- 銅イオン + 電子(2個) → 銅(原子)
銅イオンが銅板に付着するため、硫酸銅水溶液のイオンの濃度は薄くなり、溶液の色も青色から無色に変化していく。
- セロハンを使う理由
セロハンとは?→紙のようなもので目には見えない無数の穴があり、イオンが通り抜けることができる。
- 1...液体が混合するのを防ぐため。
- →当たり前のことであるが、硫酸銅水溶液と硫酸亜鉛水溶液をセロハン・仕切りを入れずにビーカーに入れたら混ざってしまう。
- 2...電気的なかたよりを防ぐため。
- →ダニエル電池では、銅板側の硫酸銅水溶液のイオンの濃度は薄くなり、亜鉛イオンが溶けだすことにより硫酸亜鉛水溶液内のイオンの濃度は濃くなっていく。ということは、銅板側では陽イオンである銅イオンが減り、-にかたよっている、亜鉛側では陽イオンである亜鉛イオンが増え、+にかたよっているといえる。そのためダニエル電池ではセロハンを通してイオンが移動する現象が起きる。亜鉛版側の亜鉛イオンが硫酸銅水溶液側に行き、銅板側の水溶液の硫酸イオンが+極側に移動する。そのため電気的なかたよりがなくなる。
身の回りの化学電池
[編集]- マンガン乾電池
マンガン乾電池の起電力の電圧は約1.5ボルトである。
マンガン電池の内部では、マイナス極に亜鉛を用いており、プラス極に二酸化マンガンを用いている。 電解質として、塩化亜鉛水溶液を用いている。
ボルタ電池のような反応がなぜ起こるかは、次の節で説明する、亜鉛板と銅板とのイオン化傾向の差による。
二次電池
[編集]- 鉛電池(なまり でんち)
自動車のバッテリーで用いられている電池である。
電極は、マイナス極に
鉛電池では、外部から逆向きに電流を加えることで、
一方、充電できない電池を
- リチウムイオン電池
携帯電話のバッテリーや、ノートパソコンのバッテリーに用いられている。二次電池であり、充電できる。
- ニッケル水素電池
デジタルカメラなどに用いられている。二次電池であり、蓄えられる電気の大きさが大きい。
燃料電池
[編集]
左側から供給された水素 H2 の一部は、正極でイオン化され、負極にたどり着き、酸素 O2 と反応し水になる。
anode = 陰極 , cathode = 正極 , Fuel = 燃料 , electrolyte = 電解質 .
酸素と水素を用いて、電気分解と逆の反応を行っている。水素などの陽極の燃料を、触媒を用いてイオン化させ、余った電子を取り出す電池。陽極の燃料が水素の場合は、陰極で酸素および回収した電子と反応し水になる。このような仕組みで、電気を取り出す装置を燃料電池(ねんりょう でんち)という。様々な方式の燃料電池がある。
- 2H2+O2 → 2H2O + 電気
一方、電気分解は、次のような反応式で表せた。
- 2H2O + 電気 → 2H2+O2
水素ガスなどからエネルギーを取り出せる燃料電池(ねんりょう でんち)は、べつに発電方法では無い。電池は、発電した電力を蓄える装置でしかない。水素ガスを作るのに、別の電力が必要になる。
石油を燃やしたりするのとは違い、燃焼を行っておらず、反応では水と電気が出来るだけなので、直接的に大気汚染をすることは無く、環境への負担が低いと考えられており、そのため燃料電池の開発が進められている。
電気分解
[編集]電解質の水溶液に、電極を2本入れて、それぞれの電極に、外部の直流電源から電気を通じると、電極で水溶液中の物質に化学反応を起こせる。これを電気分解(でんきぶんかい、electrolysis、イレクトロシス)という。あるいは略して電解(でんかい)という。
電気分解で、直流電源の負極につないだ側の電極を陰極(いんきょく、cathode、カソード)という。 電気分解で、直流電源の性極につないだ側の電極を陽極(ようきょく、anode、アノード)という。
陰極の電荷は、電源の負極から電子が送られてくるので、陰極は負電荷に帯電する。一方、陽極の電荷は、正電荷に帯電する。
なお、電極には、白金や炭素などを用いる。
一般に電気分解で反応を起こしたい対象は「水溶液」であり、電極そのものは反応を起こしたい対象ではないので、混同しないように注意のこと。外部の文献などでは、説明の簡略化のため、電気分解では「電極での反応」などという事が多いが、電極そのものが析出をするのでは無いので、間違えないように。
この電気分解の実用例として、金属の精錬に利用されている。
- 水の電気分解
純水な水は電気を通さないので、導電性を高めるために硫酸か、あるいは水酸化ナトリウムを加える。
ナトリウムは、非常にイオン化傾向が大きいので、ナトリウム原子は陰極では電子を受け取らずに、水分子がイオンを受け取るので、結果として、下記のように水素イオンが電子と反応をするので、水の電気分解が下記のように起きる。
陰極で水素 H2 が発生する。
- 陰極: 2H+ + 2e- → H2↑
陽極では、酸素 O2 が発生。
- 陽極: 4OH- → 2H2O + O2 +4e-
- 陽極: O2が発生。
このままだと、陰極と陽極の電子の数が釣り合わないので、陰極を2倍すればいい(すると、両方とも4個になる)。
- 陰極: 4H+ + 4e- → 2H2↑
- 陽極: 4OH- → 2H2O + O2 +4e-
さて、実験結果では、水の電気分解で発生する気体の体積の比率は、一定で、
- (陽極の酸素):(陰極の水素)= 2:1
である。
ちょうどこれは、上記の電子の個数がつりあった陰極と陽極の化学式での、それぞれの気体の係数に、反比例をしている。
この事と、他のさまざまな化学反応実験の結果を合わせれば、今回の実験が、この中学理科であつかった分子やイオンの考え方が正しい事の証明のひとつになる。
- (※ 範囲外)中学の検定教科書では深入りしないが、電気分解に限らず、化学合成や分解といった化学反応では、一般的に、電子の受け渡しが仲介として行われている。そのため、上記のように、電子の個数に注目して化学式を計算していった結果が、実験結果によく合う事になる。(詳しくは高校で習う。)
発展: 強電解質と弱電解質
[編集]- ※ 参考書の範囲
塩化ナトリウムのように、水に溶かすと電気を流れさせることのできる物質のことを、電解質という。
電解質のなかには、水に加えた分子のかZu の割には、電流が流れづらい物質もある事が分かっている。
たとえば、酢酸(さくさん) や、 アニモニア(アンモニア水)が、そうである。
これは、加えた分子のうち、一部しかイオンになっていないからである。このような、水に溶かしたさいに、どれだけの割合でイオンになるかを示した割合のことを「電離度」(でんりど)という(高校の範囲なので、理解できなくても良い)。
電離度の数値は、割合なので、0から1のあいだの数値を取る。
電離度は、濃度や温度などによっても変わるので、酢酸の電離度の数値は紹介しないが、ともかく、そう言う。
- ※ じつは受験研究社が、脚注で「電離度」を紹介している(P.304 の脚注)。
電離度が、一定の割合よりも低い場合、その物質のことを、弱電解質(じゃくでんかいしつ)という。
いっぽう、塩酸や硫酸、水酸化ナトリウムなどは、その多くが水の中ではイオンになるので、これを強電解質といい、電離度は大きい。
上記では、サラっと「電離」という言葉を使ったが、水溶液中で、電解質の分子がイオンになって陽イオンと陰イオンに分かれることを「電離」(でんり)という(旺文社)。
「電」解質が、陽イオンと陰イオンに分かれて「離」れるから、その名の通り「電離」と呼ぶ。
電解質の単元でも紹介したが、電流が流れるのは、あくまでイオンに分かれて電離しているときである。
なので、たとえ強電解質であっても、水に溶かしていない固体ならば、電気を流さない。
たとえば塩化ナトリウムの固体は、強電解質であるが、しかし固体のままなので、電気を流さない。
「強酸」や「強アルカリ」と、「強電解質」の考えは、別物ではある。混同しないように。
たとえば、食塩である塩化ナトリウム NaCl は、強電解質ではあり、電離度も高く、電離度は 1 に近い。しかし、NaCl は、その水溶液(食塩水)は、まったく酸性でもなければアルカリ性でもない。
このように、「強酸」・「強アルカリ」の考え方と、強電解質の考え方は、まったく別々のものである。
あまり、関連づけて考えないほうが安全だろう。(参考書でも、関連づけはしていない。
「強酸」や「強アルカリ」と、「強電解質」は、両方とも、「電離度」の考え方で、考えることができる。
なので、無理やりにでも関連づけをさせようとすれば、「強酸」「強アルカリ」と「強電解質」の関連づけをさせる事もできる。だが、上記の食塩のように、あくまで別々の考えなので、あまり関連づけをしないほうが安全である。
塩とpH
[編集]分子式が、酸とアルカリの中和で作れる分子になってる化合物を、塩(えん)と言う。
つまり、
- 酸 + アルカリ → 水 + 塩
である。
さて、強酸と弱アルカリを中和したときに得られる塩について、考える。
塩酸(これは強酸である)HClとアンモニア水(これは弱酸である(NH3水溶液)との中和で生じる塩は、塩化アンモニウム NH4Cl である。
この塩化ナトリウムを取り出して、、あらたに中性の水溶液中にこの塩化アンモニウムを加えると、下記のように電離する。
NH4Cl → NH4+ + Cl-
弱アルカリを作るもとになっているアンモニウムイオンによって作られるアルカリ性と、塩素イオンによって作られる酸性とで、全体として強酸のもとになっている塩素イオンによって生じる酸性のほうが強いので、全体として、塩化アンモニウムの水溶液は、酸性になる。
同様に、硝酸アンモニウムも、その水溶液は、酸性である。
同様に、硫酸アンモニウムも、その水溶液は、酸性である。
このように、強酸と弱アルカリからなる塩を、中性の水溶液に加えた場合は、全体として酸性になる場合が多い。
次に、今度は、弱酸である酢酸 CH3COOH と、強アルカリである水酸化ナトリウム NAOH の中和によって生じる塩である 酢酸ナトリウム CH3COONa を考えよう。
酢酸ナトリウムは、中性の水溶液中で、次のように電離する。
CH3COONa → CH3COO- + Na+
この酢酸ナトリウム水溶液は、全体として、アルカリ性を示す。
ほか、炭酸ナトリウム Na2CO3 水溶液も、全体としてアルカリ性を示す。(炭酸は弱酸であり、水酸化ナトリウムは強アルカリであるので。)
このように、弱酸と強アルカリからなる塩の水溶液は、アルカリ性を示す場合が多い。
なお、塩化ナトリウム NaCl 水溶液は、中性を示す。
これは、強酸である塩酸 HCl と 強アルカリである水酸化ナトリウム NaOH の塩として NaCl を考えれば、強酸と強アルカリとの塩であると考えることができる。
つまり、強酸と強アルカリとの塩は、中性を示す場合が多い。
同様に、いちいち式を書かないが、硝酸ナトリウム、硫酸ナトリウム、塩化カルシウム、硝酸カルシウム、硫酸カルシウム、塩化バリウム、硝酸バリウム、硫酸バリウムなど、すべて、それぞれの水溶液は中性を示す。
水酸化カルシウム Ca(OH)2 や、水酸化バリウム Ba(OH)2 は、それぞれ強アルカリであるので。
ただし、弱酸と弱アルカリとの反応は、やや特別である。
なお、暗黙の前提として、中和反応によって生じる「塩」は、電解質である。
なお、余談だが、硫酸カルシウム、硫酸バリウム、炭酸カルシウム、炭酸バリウムなどは、水に溶けにくい。
このように、電解質だからといって、水に溶けるからといって、水に溶けやすいとは限らない。
なお、塩化バリウムは、水に溶けやすい。(上記の溶けにくい物質に、塩化バリウムが無いことに注目)
このため、塩化バリウム水溶液と、硫酸銅水溶液を混ぜると、溶けにくい硫酸バリウムが出来るので、硫酸バリウムの沈殿が出来る。(受験研究社の参考書にある実験例)
- ※ 中学の範囲を超えるので、深入りしない。旺文社の参考書では紹介していない実験。
発展
[編集]発展: 電子殻
[編集]この節で扱う電子殻(でんしかく)について、詳しくは高校で習う。


原子の構造のうち、電子が並んでいる原子核の周りの部分について、より詳しく見ていこう。
- 電子殻(でんしかく、electron shell)
- 電子が飛び回っている部分全体を指す。階層構造になっている。
この電子殻は何重かにわかれており、内側から
それぞれの層に入ることのできる電子の数は決まっており、その数以上の電子が一つの層に入ることは無い。たとえば、K殻に入ることのできる電子の数は2つまでである。また、電子は原則的に内側の層から順に入っていく。M殻以降では例外もあるが、中学・高等学校の化学ではこれについては扱わない。
また、いちばん外側の電子殻にある電子を
- ※ 「価電子」という用語は中学では習わないかもしれないが、当wikiの図表の都合で、紹介する。
最外殻にそれ以上電子が入ることのできない状態を

基本的には、周期表の順番どおりに、電子が埋まっていく。だから、第一周目の水素 H とヘリウム He は、最外殻電子はK殻となる。
- ※ 本ページ内に、周期表を掲載。「周期表・付録」でページ検索すると閲覧できるようにしておく。中学校理科_第1分野/化学変化とイオン#周期表・付録
そして、周期表の2行目以降のリチム Li やベリリウム Be などは、L殻に電子が配置されはじめる。

各々の原子の電子の、電子殻への配列の仕方を
-
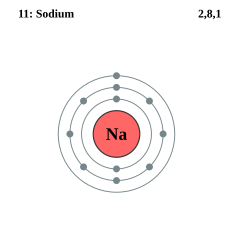
ナトリウム原子Naの電子は、K殻に2個の電子。L殻に8個の電子。M殻に1個の価電子を持つ。イオン(Na+)になったときは、最外殻の電子1個が放出されている。
電解質の場合、ナトリウムの電子殻が放出した電子の行き先は、電解質の、もう一方の原子の電気殻である。たとえば塩化ナトリウムNaClの場合、ナトリウムNaの放出した電子の行き先は、塩素原子Clの電子殻である。 -
塩素原子Clの電子は、K殻に2個の電子。L殻に8個の電子。M殻に7個の価電子を持つ。イオン(Cl-)になったときは、最外殻に電子が1個入っている。
電解質の場合、塩素の電子殻に、やってきた電子の出所は、ほかの原子である。たとえば塩化ナトリウムNaClの場合、塩素原子Clの電子殻にやってきた電子の出所(でどころ)は、ナトリウムNaから放出されている。
-
ネオンの電子配置。
-
アルゴンの電子配置。
ナトリウムがイオン化すると、電子配置はネオンNeと同じになる。(原子核は、ナトリウムNaとネオンNeは、ちがっている。) 塩素がイオン化すると、電子配置は、アルゴンArと同じになる。(原子核は、塩素 Cl とアルゴン Ar は、ちがっている。)
- 第1周期…H:水素 He:ヘリウム
- 第2周期…Li:リチウム Be:ベリリウム B:ホウ素 C:炭素 N:窒素 O:酸素 F:フッ素 Ne:ネオン
- 第3周期…Na:ナトリウム Mg:マグネシウム Al:アルミニウム Si:ケイ素 P:リン S:硫黄 Cl:塩素 Ar:アルゴン
- 第4周期…K:カリウム Ca:カルシウム
| 原子番号 | 元素記号 | K殻 | L殻 | M殻 | N殻 | |
|---|---|---|---|---|---|---|
| 1 | H | 1 | ||||
| 2 | He | 2 | ||||
| 3 | Li | 2 | 1 | |||
| 4 | Be | 2 | 2 | |||
| 5 | B | 2 | 3 | |||
| 6 | C | 2 | 4 | |||
| 7 | N | 2 | 5 | |||
| 8 | O | 2 | 6 | |||
| 9 | F | 2 | 7 | |||
| 10 | Ne | 2 | 8 | |||
| 11 | Na | 2 | 8 | 1 | ||
| 12 | Mg | 2 | 8 | 2 | ||
| 13 | Al | 2 | 8 | 3 | ||
| 14 | Si | 2 | 8 | 4 | ||
| 15 | P | 2 | 8 | 5 | ||
| 16 | S | 2 | 8 | 6 | ||
| 17 | Cl | 2 | 8 | 7 | ||
| 18 | Ar | 2 | 8 | 8 | ||
| 19 | K | 2 | 8 | 8 | 1 | |
| 20 | Ca | 2 | 8 | 8 | 2 |
「イオン化」の現象とは、最外殻電子が閉殻していない原子から、たとえば電子が外れたり、あるいは逆に空いている部分に電子が入る事である。
たとえば、ナトリウムがイオン化すると、最外殻電子のM殻にあった1個の電子を放出するので、そのナトリウムイオンの電子配置は、Mの一つ前のL殻の電子配置と同じになり(「閉殻」の構造)、比較的に安定する。
イオン化の反応にかぎらず、一般的によくある反応の直後で安定している場合は、原子の周囲の電子配置は、閉殻の電子配置になっているので、安定する、という仕組みになっているのが普通である。
ヘリウムや、ネオンやアルゴンなどの周期表18族原子は、右の表を見れば分かるように、最外殻電子が満杯の状態になっている。このため、18族のヘリウム、ネオン、アルゴンは、安定しており、化学反応しづらい。
18族以外の他の原子でも、イオン化や化学反応などによって、最外殻の電子配置が満杯になると、その原子や分子などは安定する。なので、水溶液中などでは、電子配置が、最外殻電子を埋めるように、もしくは最外殻電子をなくすように、反応をする。
この結果、周期表を見ることで、イオンになった場合の電荷の数や符号が、だいたい予想できる。
水素H、リチウムLi、ナトリウムNaなど、周期表の1族の原子がイオンになったとき、イオンはそれぞれ、H+、Li+、Na+、・・・というふうに、イオンの電気がプラス1である。
逆に、塩素は、周期表の17族にあるが、電子が1個だけ増えると、18族の電子配置と同じになるので、塩素イオンCl-というふうに、塩素イオンの電気はマイナス1ということが、周期表からも予想できる。
イオンに限らず、分子をつくる反応でも、最外殻電子の電子数を安定配置にする方向に、反応が進む。
たとえば水素Hの気体が、水素分子H2として存在する理由も、2個の水素原子が最外殻電子を1個ずつ共有すると、電子配置がヘリウムと同じになり、安定するからである。
酸素分子も同様であり、2個の酸素原子が、電子を2個ずつ共有すれば、16族の酸素原子は、ちょうどネオン(18族)の電子配置と同じになる。
固体の塩化ナトリウムでも、ナトリウムの電子1個が、塩素の電子殻に移動することで、それぞれ電子殻が安定する。
電子殻について、詳しくは高校で習う。
しかし、K殻よりも小さい殻は発見されませんでした。
周期表・付録
[編集]「周期表・付録」
- 周期表
| 1 | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 H 水素 |
2 | 13 | 14 | 15 | 16 | 17 | 2 He ヘリウム | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 Li リチウム |
4 Be ベリリウム |
5 B ホウ素 |
6 C 炭素 |
7 N 窒素 |
8 O 酸素 |
9 F フッ素 |
10 Ne ネオン | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 11 Na ナトリウム |
12 Mg マグネシウム |
3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 Al アルミニウム |
14 Si ケイ素 |
15 P リン |
16 S 硫黄 |
17 Cl 塩素 |
18 Ar アルゴン | ||||||||||||||||||||||||||||||||||||||||
| 19 K カリウム |
20 Ca カルシウム |
21 Sc スカンジウム |
22 Ti チタン |
23 V バナジウム |
24 Cr クロム |
25 Mn マンガン |
26 Fe 鉄 |
27 Co コバルト |
28 Ni ニッケル |
29 Cu 銅 |
30 Zn 亜鉛 |
31 Ga ガリウム |
32 Ge ゲルマニウム |
33 As ヒ素 |
34 Se セレン |
35 Br 臭素 |
36 Kr クリプトン | ||||||||||||||||||||||||||||||||||||||||
| 37 Rb ルビジウム |
38 Sr ストロンチウム |
39 Y イットリウム |
40 Zr ジルコニウム |
41 Nb ニオブ |
42 Mo モリブデン |
43 Tc テクネチウム |
44 Ru ルテニウム |
45 Rh ロジウム |
46 Pd パラジウム |
47 Ag 銀 |
48 Cd カドミウム |
49 In インジウム |
50 Sn スズ |
51 Sb アンチモン |
52 Te テルル |
53 I ヨウ素 |
54 Xe キセノン | ||||||||||||||||||||||||||||||||||||||||
| 55 Cs セシウム |
56 Ba バリウム |
*1 ランタノイド |
72 Hf ハフニウム |
73 Ta タンタル |
74 W タングステン |
75 Re レニウム |
76 Os オスミウム |
77 Ir イリジウム |
78 Pt 白金 |
79 Au 金 |
80 Hg 水銀 |
81 Tl タリウム |
82 Pb 鉛 |
83 Bi ビスマス |
84 Po ポロニウム |
85 At アスタチン |
86 Rn ラドン | ||||||||||||||||||||||||||||||||||||||||
| 87 Fr フランシウム |
88 Ra ラジウム |
*2 アクチノイド |
104 Rf ラザホージウム |
105 Db ドブニウム |
106 Sg シーボーギウム |
107 Bh ボーリウム |
108 Hs ハッシウム |
109 Mt マイトネリウム |
110 Ds ダームスタチウム |
111 Rg レントゲニウム |
112 Cn コペルニシウム |
113 Nh ニホニウム |
114 Fl フレロビウム |
115 Mc モスコビウム |
116 Lv リバモリウム |
117 Ts テネシン |
118 Og オガネソン | ||||||||||||||||||||||||||||||||||||||||
| *1 ランタノイド: | 57 La ランタン |
58 Ce セリウム |
59 Pr プラセオジム |
60 Nd ネオジム |
61 Pm プロメチウム |
62 Sm サマリウム |
63 Eu ユウロピウム |
64 Gd ガドリニウム |
65 Tb テルビウム |
66 Dy ジスプロシウム |
67 Ho ホルミウム |
68 Er エルビウム |
69 Tm ツリウム |
70 Yb イッテルビウム |
71 Lu ルテチウム | ||||||||||||||||||||||||||||||||||||||||||
| *2 アクチノイド: | 89 Ac アクチニウム |
90 Th トリウム |
91 Pa プロトアクチニウム |
92 U ウラン |
93 Np ネプツニウム |
94 Pu プルトニウム |
95 Am アメリシウム |
96 Cm キュリウム |
97 Bk バークリウム |
98 Cf カリホルニウム |
99 Es アインスタイニウム |
100 Fm フェルミウム |
101 Md メンデレビウム |
102 No ノーベリウム |
103 Lr ローレンシウム |
||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
書籍などでの実際の周期表には、つぎのように、原子番号や質量が、元素記号のとなりに書かれる。
- (水素原子を例にとった。)
左上の数字は原子番号で、左下の数字は炭素原子12Cの質量を12としたときの、その原子のおよその質量である。
書籍によっては、書く位置が違う場合もあるので、その書籍ごとに確認のこと。
それぞれの原子を羅列していくと、
- 元素の周期
- 第1周期
- 第2周期
- 第3周期
というようになる。
参考: 炎色反応
[編集]- (※ 炎色反応は、2014年の現在では、中学校では、扱わない。もし読者に時間に余裕があれば、読んでもらいたい。)
化学反応で発生したイオンを調べる方法には、様々な方法があるが、一つの方法として、次に説明する炎色反応が応用できる。
ナトリウムやカリウム、カルシウムなどのある種の元素は、炎の中に入れると、元素の種類ごとに特有の色の炎が上がる。
このような現象を
 |
 |

|
| Li | Na | K |
- 炎色反応の元素と色の一覧
- リチウム: 赤
- カリウム: 赤紫
- ナトリウム: 黄色
- カルシウム: 橙(オレンジ色っぽい色のこと)
- 銅: 青緑
- バリウム: 緑
中学の段階では、元素と色の対応を、無理に覚える必要はない。
-
試料を加えない場合のガスバーナーの色
-
ナトリウム
-
ナトリウム(コバルトガラスを通した場合)
-
カリウム
-
カルシウム
-
リチウム
-
銅
-
ホウ素
-
アンチモン
花火の色は、炎色反応を利用しているのが、一般である。