高等学校化学I/物質と原子
物質と元素
[編集]物質の要素
[編集]| 番号 | 名称 | 元素記号の例 |
|---|---|---|
| 1 | 水素 | H |
| 6 | 炭素 | C |
| 7 | 窒素 | N |
| 8 | 酸素 | O |
| 16 | 硫黄 | S |
| 20 | カルシウム | Ca |
| 26 | 鉄 | Fe |
| 29 | 銅 | Cu |
| 47 | 銀 | Ag |
| 79 | 金 | Au |
物質は、原子(げんし、atom)という基本構造が組み合わさることによって構成されている。
- 元素
- 原子の種類のことを元素(げんそ、element)という。
この元素は、現在では110種類ほどであり、これらのうち約90種類は天然に存在している。元素をあらわす記号には、ラテン語名などの頭文字から1文字または2文字をとった元素記号(げんそきごう、symbol of element)で表される。元素記号の1文字目は必ず大文字であり、2文字目は必ず小文字である。代表的な元素の元素記号を右の表に記したので、参考にしてほしい。詳しい元素記号の表は、元素記号(周期表)に掲載しておいた。
- ※ 「元素記号」のことを「原子記号」ともいう(※ 参考文献: チャート式)。
元素の確認方法
[編集]炎色反応
[編集]
元素の確認方法には、さまざまな方法があるが、炎色反応で確認することができる。たとえば塩化ナトリウム水溶液をつけた白金線、または水酸化ナトリウム水溶液をつけた白金線を、ガスバーナーの外炎に当てると、黄色い炎が出る。
これは、ナトリウム元素 Na による現象である。塩化ナトリウムも水酸化ナトリウムも、どちらの物質とも、Na を含んでいる。
-
試料を加えない場合のガスバーナーの色
-
リチウム(赤)
-
ナトリウム(黄色)
-
ナトリウム(※ コバルトガラスを通した場合)
-
カリウム(赤紫)
-
カルシウム(橙赤)
-
ストロンチウム(赤)
-
銅(青緑)
このように、物質を炎の中に入れたとき、その物質に特有の色の炎が見られる現象を炎色反応(えんしょくはんのう、flame reaction)という。炎色反応の色は、元素の種類によって異なるので、元素の種類を調べたい時に炎色反応で元素の種類を確認する事ができる。
なお、花火の色は、炎色反応を利用したものである。
石灰水と二酸化炭素
[編集]石灰水(水酸化カルシウム水溶液)は、二酸化炭素を吹き込まれることで、白く沈殿する。これは、水に不溶の CaCO3 が発生したためである。
この一連の現象を利用して、ある気体中での二酸化炭素の有無を確認できる。
また、ある物質を酸化させて燃やした時に発生する気体が、石灰水を白く濁らせれば、その物質には炭素が含まれることが判別できる。
- 具体例
大理石に希塩酸をそそぐと気体が発生する。この気体を、水酸化カルシウム水溶液にそそぐと、白く沈殿する。このことから、大理石には炭素Cが含まれてることが分かる。なお、生じた白色沈殿は炭酸カルシウムである。
沈殿
[編集]食塩水(水酸化ナトリウム水溶液)に硝酸銀水溶液を加えると、白色沈殿(塩化銀)が生じる。
この沈殿反応を利用することで、ある水溶液中に銀 Ag または塩素 Cl が含まれているか否かを判別できる。
参考:スクロースの成分元素の検出
[編集]- (※ 未記述. 執筆協力者を募集)
物質の構成
[編集]単体と化合物
[編集]たとえば水を電気分解すると、水素と酸素の気体が2:1の比で分離する。水素だけからなる気体、酸素だけからなる気体など、一つの元素のみから構成されている物質を単体(たんたい、simple substance)という。
単体の例をあげると、たとえば、純粋な銅は、銅元素のみからなる単体である。純粋な水素の気体は、水素元素のみからなる単体である。
いっぽう、水は、水素と酸素が結合している。このように、2種類以上の元素から成り立つ物質を化合物(compound)という。
水(H2O)はH元素とO元素からなる分子から構成されている化合物である。他にも、酸化銅II(CuO)や、塩化アルミニウム(AlCl3)など、化合物には、いくつもの種類がある。
同素体
[編集]-
黒鉛
-
ダイヤモンド
黒鉛とダイヤモンドは、ともに炭素 C からなるが、色・電気伝導性など、性質が異なる。このように、ある元素の単体どうしで、元素の結びつき方が違うために性質が違うもののことを、たがいに同素体(どうそたい、allotrope)という。 たとえば「黒鉛はダイヤモンドの同素体である」といった具合に、この言葉を使用する。当然、組み合わさり方が一種類しかないような元素には、同素体は無い。
硫黄 S の同素体には、斜方硫黄(しゃほう いおう)と単斜硫黄(たんしゃいおう)およびゴム状硫黄がある。斜方硫黄(しゃほう いおう)と単斜硫黄(たんしゃいおう)およびゴム状硫黄は、これらはいずれも単体であるが、化学的性質が異なる。
赤リン(せきリン)と黄リン(おうリン)は、リン P の同素体である。
| 同素体の例 | ||
|---|---|---|
| 炭素(C)の同素体 | 黒鉛 | 黒色。やわらかい。電気を通す。 |
| ダイヤモンド | きわめて硬い。電気を通さない。無色透明。 | |
| 硫黄(S)の同素体 | 斜方硫黄 | 常温で安定。 |
| 単射硫黄 | 針状。常温で放置すると、やがて斜方硫黄になる。 | |
| ゴム状硫黄 | 弾力性がある。 | |
| リン(P)の同素体 | 赤リン | 化学的に安定。毒性は少。 |
| 黄リン | 空気中で自然発火するので、水中に保存する。猛毒。 | |
ほかにも炭素の同素体として、フラーレンやカーボンナノチューブなどが知られている。しかしフラーレンなどの説明には高度な専門性を要するので、ここでは詳細は述べない。
純物質と混合物
[編集]

- 純物質
- 物質が単体か化合物であるとき、その物質を純物質(pure substance)と呼ぶ。
純物質は、物理的操作(叩く、引っ張る、ろ過する、といった操作)によってそれよりも小さい構成パターンに分けることができないようなパターンの集まりだと考えられる。ここで言うパターンとは、元素の組み合わせのことである。単体や化合物は、物理的な操作だけではその構成を変えることができない。例えば、水は蒸発させても凍らせても叩いてもろ過しても、水のままである。しかし、電気分解を行うことで水素と酸素に分解できることは、中学校で学習した通りだ。具体的には、前者を物理的操作、後者を化学的操作と呼ぶ。

(※ 小学生用の画像ですが、組成は同じですので、容赦してください。)
- 混合物
- 2種類以上の物質が混ざった物質のことを混合物(こんごうぶつ、mixture)と言う。食塩水は混合物である(なぜなら、水と食塩とが混同しているので)。
なお、(※ 教科書には書かれてないが、)塩化ナトリウムそのものは純物質である。
海水は混合物である。(※ 海水の組成は覚えなくてもいいが、まず海水には食塩(塩化ナトリウム)が含まれてるので、その時点ですでに塩化ナトリウムと水との混合物。さらに海水には塩化マグネシウムなども含まれているので、より混合物である。)
空気は混合物である。なぜなら、空気には窒素や酸素などが混ざっているからである。窒素そのものは純物質である。酸素そのものは純物質である、
牛乳は混合物。石油は混合物。
ドライアイスは純物質。氷(こおり)は普通、純物質。
純粋な銅(どう)は純物質である(合金などは除外する)。純粋な鉄そのものは純物質である(合金などは除外する)。硫黄(いおう)は純物質。エタノールは純物質。
(検定教科書には書かれてないが、)ほかにも、塩酸は塩化水素(HCl)と水(H2O)の混合物である(※ チャート式など参考書で紹介)。
(※ チャート式など参考書で紹介)花崗岩(かこうがん)も混合物である。
※ 純物質と混合物の分類の定義に対しては、直観的な理解で、かまわない。しかし、ある物質が純物質か混合物かについては、しっかりと把握すべきである。
物質の構成による分類
[編集]これまでに学習した単体、化合物、混合物についてまとめた。右側には具体例となる物質を挙げたので、参考にしてほしい。
| 物質の構成 | 具体例 | ||
|---|---|---|---|
| 物質 | 純物質 | 単体 | 鉄(Fe)、水素(H2)、酸素(O2)、など |
| 化合物 | 水(H2O)、酸化銅(II)(CuO)、など | ||
| 混合物 | 食塩水(水と塩化ナトリウム)、海水、空気、など | ||
原子の構造と元素の周期表
[編集]原子の構造
[編集]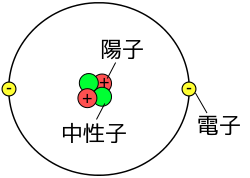
原子(げんし)は、中心にある原子核(atomic nucleus)と、その周り(電子殻、electron shell)を飛び回るいくつかの電子(electron,図では黄色)からなる。原子の形状は、球状の構造である(円状ではなく、球状である)。(※ 電子殻(でんしかく)については後述する。)
右に示した図で言えば、真ん中の赤い粒が陽子(ようし、proton)、おなじく真ん中の黄緑色の粒が中性子(ちゅうせいし、neutron)。それから、周りにある黄色い粒が電子である。全ての原子は、このような「原子核の周りに電子」という構造をしていると考えられている。
原子核
[編集]原子核は、何個かの陽子(ようし、proton)と何個かの中性子(ちゅうせいし、neutron)からなる。
原子の大きさは、だいたい半径 10-8 cm である(= 100億分の1メートル 、つまり 10-10 m )。原子核はさらに小さく、原子核の大きさは半径 10-15 m である。
比喩(ひゆ)として、原子をドーム球場の大きさに例えると、原子核の大きさは1円玉やビー玉の大きさに相当することになる。
原子はあまりに小さいため、電子顕微鏡などを用いなければ形状を観察することができない。原子核は、正の電荷(charge)を持っている。基本的に原子核は壊れない(※ 高校化学の段階では、とくに断りのないかぎり、原子核は壊れない、として扱ってよい)。
- (※ 範囲外: )右上図のボーアモデルのような、原子核と電子の位置関係がなぜ分かったかというと、様々な実験にもとづいているが、特に代表的な実験としては、放射線を用いて原子核を研究した物理学者ラザフォードによる、金箔などに放射線(ラジウムを用いてアルファ線を出す実験をしていた)を当てる実験によって大きく解明された[1]。(くわしくは物理2 科目の 高等学校物理/物理II/原子と原子核 で習う。ラザフォードの時代には、まだ中性子や陽子などといった原子核の中身の個別の粒子が知られていなかったので、のちに物理学者ボーアなどによって中性子や陽子などの知見を加えたボーアモデルに改良された。)
原子の電荷
[編集]陽子が持つ電荷は、電子が持つ電気と大きさが同じで、符号が反対である。化学式などでは一般に、電子の電荷の大きさを最小単位として表す。つまり、電子の電荷を -1 として表す。このため、陽子の電荷を +1 として表す。
中性子は電荷を持たない。中性子の電荷は 0 である。
| 構成粒子 | 電荷 | 質量[g] | 質量比 | |
|---|---|---|---|---|
| 原子核 | 陽子 | 1.673×10-24 | ||
| 中性子 | 1.675×10-24 | |||
| 電子 | 9.109×10-28 | |||
原子に含まれる陽子の数を原子番号(げんしばんごう、atomic number)という。元素ごとに、陽子の数は決まっているので、つまり元素が決まれば、原子番号も決まる。たとえば水素は陽子を1個持つので、水素の原子番号は1である。
- ※ ちなみに、電子1個の電荷は、物理学的には、-1.602×10-9〔C〕である。単位 c はクーロンと読む。陽子1個の電荷は、物理学的には、1.602×10-9〔C〕である。この 1.602×10-9〔C〕の大きさを、化学では計算を簡単化するため、単位1として扱っているわけである。なお、1.602×10-9〔C〕の大きさのことを「電気素量」(でんきそりょう)という。
原子の質量
[編集]原子核中での、電子の数と陽子の数は、同じである。よって原子核は、全体としては電荷をもたない。よって原子核は電気的に中性である。 また、陽子の質量と中性子の質量は、ほぼ同じである。
電子の質量は、陽子の約 倍である。よって原子の質量は、ほぼ原子核の質量になる。そして、陽子1個の質量と中性子1個の質量はほぼ同じである。ある原子1個での、陽子数と中性子数との和を、質量数(しつりょうすう、mass number)という。
つまり、ある元素の原子1個あたりの質量は、原子核1個中の陽子と中性子の質量数の和に、比例する。
具体例として、通常の水素 H の質量数は1である。通常の水素の原子核は、陽子1個のみである。
通常のヘリウム He の質量数は4である。なぜなら通常のヘリウムの原子核は、陽子2個と中性子2個からなる。
- 参考
- 中性子だけでは原子核にはならない。いっぽう、水素原子のように、陽子だけでも原子核は成り立つ場合がある。
- 原子の構造は、高等学校の化学においては一般的に、ボーアの原子模型と呼ばれるモデルを使って理解する。
ある元素記号の質量数を表す場合、 のように、原子の左上に小さく書いて示す(例ではヘリウムを例にした)。 原子番号も書く場合は、 のように、左下に原子番号を書き、左上に質量数を書く。
- かりに質量数をMとして、その元素記号をXとすると、MX のように書き表す。
質量数はあくまで、陽子と中性子の個数の和であり、質量そのものではないことに注意が必要である。さらに言えば、これら質量数はあくまで指標であり、実際の質量は厳密には異なってくる。
- ※ 単元『高等学校化学I/物質量と化学反応式』のページで、ある質量数の原子の個数と実際の質量との関係について解説する。
同位体
[編集]同位体
[編集]| 同位体 | |||
|---|---|---|---|
| 陽子の数 | 1 | 1 | 1 |
| 中性子の数 | 0 | 1 | 2 |
| 質量数 | 1 | 2 | 3 |
| 電子の数 | 1 | 1 | 0 |
天然に存在する水素原子の大部分は、原子核が陽子1個だけからなる であるが、水素には、この他にも陽子1個と中性子1個からなる も少量ながら存在する。
このように、原子番号が同じでも質量数が異なる原子のことを、たがいに同位体(どういたい、isotope)であるという。あるいは同位体のことをアイソトープ(isotope)ともいう。
| 元素 | 同位体 | 存在比(%) | |
|---|---|---|---|
| 水素 | 99.9885 | ||
| 0.0115 | |||
| 炭素 | 98.93 | ||
| 1.07 | |||
| 酸素 | 99.757 | ||
| 0.038 | |||
| 0.205 |
水素の同位体には、さらに も、ごくわずかにある。
なお、「同位体」という名前が「同素体」と似ているが、異なる概念なので、混同しないように読者は注意のこと。
のことを重水素(じゅうすいそ)という。また のことを三重水素という。
同位体どうしは質量が異なるが、化学反応などの化学的性質はほぼ同じである。なぜなら、原子核に含まれる陽子の数が同じだからである。
炭素Cの代表的な同位体には、12C と13C がある。
放射性同位体
[編集]炭素Cの同位体には14Cも存在する場合もあるが、この14Cは不安定であり、すぐに崩壊(ほうかい)して質量数が変わってしまう。原子核が壊れるとき、一般に放射線をだすので、不安定な同位体が壊れたときも放射線を出す。14Cも崩壊するときに放射線を出す。 14Cのような、すぐに崩壊して放射線を出す同位体を放射性同位体(ほうしゃせいどういたい、ラジオアイソトープ,radioisotope)という。 これに対して安定して存在できる同位体を安定同位体(stable Isotope)という。
原子力発電所の原子炉内では、質量数3の水素3Hも存在する。この水素3Hを三重水素(さんじゅうすいそ、tritium トリチウム)という。3Hは放射性同位体である。
なお、すべての元素に、自然界で同位体が存在するわけではない。 Be,F,Na,Al,P,Sc,Mnなどには、天然には同位体は存在しない。
放射性同位体の活用としては、化学反応のしくみを追跡するときに利用される。ほかにも、年代測定などにも利用される。
なお、放射性に関する用語として、放射線を出す性質のことを「放射能」(radioactivity)という。放射線を出すなどして、原子が他の原子に変わることを「崩壊」という。
原子ごとに、原子核が変わるまでの、だいたいの時間が異なる。半分の量の原子核が変わるまでの時間を半減期(はんげんき、half life)という。
14Cの半減期は5830年である。例えば14Cの量が元の1/8になっているなら 1/8=(1/2)3なので5830×3=17490年経過している。
- (※ 高校化学の範囲外: 生物の範囲: )放射性同位体を使った実験の前提として、放射性同位体の原子ばかりを周囲の通常の原子から分離する工程が必要である。では、そもそもどうやって分離するのかというと、一例として、遠心分離機などを用いて質量差に起因する遠心力の差によって分離する方法がある(遠心分離法)。遠心分離法は、よく生物学の放射性同位体をもちいた実験でも使う。
- (※ 高校の範囲外: )遠心分離法の他にも、温度差や熱を用いた熱拡散法による分離もある。その他、溶解した状態で電気を流すと質量差によって泳動する速度がちがうことを利用する方法や(「電気泳動法」といわれるが、生物学でいう同名の方法とは若干ちがう)、ほかには蒸留を用いた方法など、さまざまな方法がある[2]。
- このように、割と普通の方法で放射性同位体をほかの原子から分離できるので、高校生としては、同位体の分離法については特に悩む必要は無い。
- 範囲外: 「軽水」(けいすい)とは?
原子力工業などでいう「軽水」(けいすい)とは、重水素を含まない普通の水の事である。(※ 参考文献: 電気学会『電気学会大学講座 発電工学 〔改訂版〕』、2015年改訂版) 原子力工業の分野では、重水素を含んでいて普通でない水のことを「重水」(じゅうすい)と呼んでいる。原子力工業の用語では、「重水」に対して、普通の水素の化合によって出来た水のことを「軽水」と呼んで、原子力工業では区別している。
- ※ しかし、高校生にとっては、「軽水」は一般の化学用語ではないので、覚える必要は無い。
また、原子力の分野や、放射性同位体をつかった化学分析の分野では、一般の水素原子を「重水素」と区別するために、一般の水素原子のことを「軽水素」という場合もある。(※ 参考文献: サイエンス社『工学のための無機化学 新訂版』、橋本和明ほか著、2016年新訂第1版、118ページ) だが、けっして普通の水素とは別に「軽水素」なんて元素があるわけではない。普通の水素原子を重水との区別のために「軽水素」と呼んでいるだけである。
- ※ 中学高校の理科では、特にことわりのないかぎり、「水素原子」といったら、一般の水素 のことであるので、「軽水」「軽水素」の用語は高校生は覚えなくて良い。
電子殻と価電子
[編集]
| K殻 | L殻 | M殻 | O殻 | P殻 | |
|---|---|---|---|---|---|
| He | 2 | ||||
| Ne | 2 | 8 | |||
| Ar | 2 | 8 | 8 | ||
| Kr | 2 | 8 | 18 | 8 |


原子の構造のうち、電子が並んでいる原子核の周りの部分について、より詳しく見ていこう。
- 電子殻(でんしかく、electron shell)
- 電子が飛び回っている部分全体を指す。階層構造になっている。
この電子殻は何重かにわかれており、内側からK殻(ケーかく、K shell)、L殻(エルかく、L shell)、M殻(M shell)、……と呼ぶ。それぞれの層に入ることのできる電子の数は決まっており、その数以上の電子が一つの層に入ることは無い。たとえば、K殻に入ることのできる電子の数は2つまでである。また、電子は原則的に内側の層から順に入っていく。M殻以降では例外もあるが、高等学校の化学ではこれについては扱わない。内側から数えてn番目の電子殻に入ることのできる電子の数は、最大2n2までである。
- ※ M殻の次が上記の表で、「N殻」ではなく「O殻」になっているのは、マチガイではない。現時点では理由を説明できないので、説明は今は省略。詳しくは、「遷移金属」(せんい きんぞく)を習うと分かる。
- ※ 「N殻」というのも存在する。カリウム K やカルシウム Ca では、N殻に電子が入る。
また、いちばん外側の電子殻にある電子を最外殻電子(さいがいかく でんし、outermost-shell electron)という。ある原子とある原子との接点が、実際には電子殻であるため、原子の結合の仕方などはこの最外殻電子の個数が重要になってくる。ある原子での最外殻電子の数を価電子(かでんし、valence electron)という。
各々の原子の電子の、電子殻への配列の仕方を電子配置 (でんしはいち、electron configuration)という。
- ※ そもそも「価電子」が本当に電子なのかどうかの根拠は、高校レベルでは、いちおう、高校化学のあとの単元で習う『電気分解』などの電気化学の実験結果により、反応した物質の量から算出される「価電子」の数と、電気回路によって与えた電気量から算出される「電子」の数とが一致するので、価電子は電子だと思われている。
- なお、電子1個の電気量そのものの数値の証明は、高校「物理」でならうミリカンの油滴の実験などで検証されている。
ヘリウムやネオンは、安定しており、化合物をつくりづらい。ヘリウムガスは、化合してないヘリウム原子が気体そのものの成分であり、分子化合物ではない。同様にネオンガスも原子の気体であり、分子ではない。
ヘリウムの電子配置は、K殻に2個ぜんぶの電子が配置されていて、安定しているので、このような化学的安定をしている。
同様に、ネオンの電子配置は、L殻に8個ぜんぶの電子が配置されてるので、安定している。
このように、最外殻にそれ以上電子が入ることのできない状態を閉殻(へいかく)という。閉殻になっている原子の価電子の個数は0であると約束する。
なお、ヘリウム、ネオン、アルゴンなどの原子のことを希ガス(きガス、Noble gases)原子という。希ガス原子は、ほかの原子とは化合せず、希ガスどうしとも化合しておらす、希ガスそのものが分子と同様に安定してふるまうので、「単原子分子」(たんげんし ぶんし、monoatomic molecule)である。

-
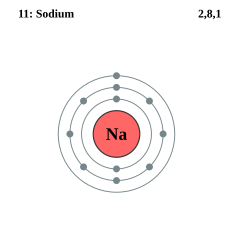
ナトリウム原子Naの電子は、K殻に2個の電子。L殻に8個の電子。M殻に1個の価電子を持つ。
-
塩素原子Clの電子は、K殻に2個の電子。L殻に8個の電子。M殻に7個の価電子を持つ。
| 原子番号 | 元素記号 | K殻 | L殻 | M殻 | N殻 | |
|---|---|---|---|---|---|---|
| 1 | H | 1 | ||||
| 2 | He | 2 | ||||
| 3 | Li | 2 | 1 | |||
| 4 | Be | 2 | 2 | |||
| 5 | B | 2 | 3 | |||
| 6 | C | 2 | 4 | |||
| 7 | N | 2 | 5 | |||
| 8 | O | 2 | 6 | |||
| 9 | F | 2 | 7 | |||
| 10 | Ne | 2 | 8 | |||
| 11 | Na | 2 | 8 | 1 | ||
| 12 | Mg | 2 | 8 | 2 | ||
| 13 | Al | 2 | 8 | 3 | ||
| 14 | Si | 2 | 8 | 4 | ||
| 15 | P | 2 | 8 | 5 | ||
| 16 | S | 2 | 8 | 6 | ||
| 17 | Cl | 2 | 8 | 7 | ||
| 18 | Ar | 2 | 8 | 8 | ||
| 19 | K | 2 | 8 | 8 | 1 | |
| 20 | Ca | 2 | 8 | 8 | 2 |
電荷
[編集]原子の構造を理解する助けとして、これから先になって必要になってくる概念である電荷という言葉については、ここで簡単な説明を加えておく。
- 電荷(electric charge)
- 粒子にある電気的な性質のこと。プラスの量とマイナスの量があり、当然ながら0も存在する。
この電荷という概念は、高等学校物理などでも扱う。電荷を持った粒子がどのような振る舞いをするかについて興味を持ったなら、そちらを参考にすると良い。
電荷を持った粒子は基本的に次の性質を持っている。これらを知っていれば、高等学校の化学においては十分であろう。
- 同じ符号の電荷を持った粒子同士は反発する力が働く。
- 逆の符号の電荷を持った粒子同士は引き合う力が働く。
- 電荷を持った粒子どうしに働く力は、距離が近いほど大きくなる。
ある原子核に陽子が3つ含まれているとき、原子核全体の電荷は
- +e × 3 = +3e
と表される。さらに、この原子核の周りに電子が3つ回っているならば、原子全体の電荷は、
- (+3e) + (-3e) = 0
となる。これは、原子全体では電荷を持っていないということである。このことがらを利用すれば、原子全体の電荷や、原子の名称などから、それにいくつの陽子や電子が含まれているかを計算することができる。
高校の物理の範囲では、化学反応を説明できない
[編集]高校の「物理」で習う電気の内容だけでは、化学での価電子のふるまいなどを理解することはできない。だから高校生は、物理とは別に、化学の理論も覚える必要がある。
たとえば、「なぜ、電子にはK殻、L殻などといった電子殻(でんしかく)があるのか?」などといった基本的な問いさえ、高校物理の電気・磁気の知識では説明不可能である。原子どうしの結合の起こる理由すら、高校物理では、説明不可能である。
- 問いの答えを話すと、量子力学(りょうし りきがく)のシュレーディンガーの方程式や、ディラックの方程式によって、これら化学での電子の振る舞いについての問いの答えが、数学的に証明できたとされている。
電子殻については、量子力学の以前でも、周期表が19世紀にメンデレーエフによって発見されたことや、さまざまな実験結果によって、電子殻のような、現象が存在することは、19世紀ころ(1800年~1900年ごろ)から分かっていた。だが、ではなぜ、そのような電子殻といった仕組みがあるのか、量子力学の以前は、まだ分からなかったのである。
量子力学の以前でも、電気分解などの実験によって、化学反応には電子が関わることは分かっていたし、周期表などから、原子のもつ電子の数も分かっていた。原子核に陽子や中性子のような物があることも、原子の電子軌道上にもつ電子と、原子の質量の分析から、分かっていた。しかし、ではなぜ、原子核のもつ陽子や中性子の数が、そのような数に決まるのか、まったくもって理由が不明だったのである。
シュレーディンガー方程式とディラック方程式の解法は、とても難解であり、高校レベルを遥かに越える難度で、理系の大学学部の高学年~大学院レベルである。しかも、数学や物理や化学を専門にする学科の大学生の場合で、大学高学年~大学院で、やっと、解けるというレベルである。
たいていの大学生の受ける大学の授業では、大学1年~2年での化学の授業で、学生が理解するよりも先に、シュレーディンガー方程式・ディラック方程式によって20世紀の化学者が分かった結果を習い、学生は結果を鵜呑みすることになる。
とても、一般の高校生には、シュレーディンガー方程式などによる化学反応の証明は手が追えないので、シュレーディンガー方程式およびディラック方程式に深入りしてはならない。
科学技術の歴史的にも、物理学において、現代のような、原子や電子にもとづく化学反応の仕組みが分かったのは、だいぶ後の時代であり、1900年すぎごろから、量子力学や相対性理論などの学問が発達してからである。1800年代までは、そもそも「原子」や「分子」といったものが存在するということの証明すら、とても難しかったのである。
また、1800年代ころの昔は、原子と分子との区別すら、まだ、あまり区別されてなくて、混同されていた時代だったのである。
つぎの章の以降で話す、原子の仕組みについても、同様に、高校物理の電気の知識では、説明できない。量子力学よりも前の昔は、化学での原子の仕組みが「なぜ、そうなるのか?」が分からなかったのである。
だから、高校生は、先に結果を覚える必要がある。
原子に関する諸概念
[編集]原子の分類
[編集]原子の化学反応的な性質は、その原子の原子核に含まれる陽子の数で決まる。なぜなら、電子殻上の電子が、化学反応では媒介(ばいかい)になるのだが、電子殻上のその電子の数は、原子核中の陽子の数と、同じだからである。このため原子番号の定義を、陽子の数として定義することは、合理的である。
実は、元素の分類、つまり原子がどの元素に属するかという判断は、その原子の原子核に含まれる陽子の数によって行われている。例えば、水素(H)に属する原子の場合、それに含まれる陽子の数は必ず1個である。同じように、炭素(C)に属する原子の原子核には、必ず6個の陽子が含まれている。逆に、ある原子の原子核に陽子が6個含まれるなら、その原子は炭素である。
| 原子番号と元素記号と陽子の数の対応の例 | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| ||||||||||||||||||||||||||||||||
周期表と周期律
[編集]
元素を原子番号の順に並べると、性質のよく似た元素が周期的に現れることがある(例:1価の陽イオン(→高等学校化学Ⅱ/化学結合)になりやすい物質……3Li、11Na、19K、など。ここまでは8個間隔で現れている)。このことを元素の周期律(periodic law)という。また、図のような表を、周期表(periodic table)という。
元素を原子番号の順に並べて、かつ周期律に併せて配列した表のことを周期表という。周期表の縦の列を族(group)といい、同族内では性質のよく似た元素が並ぶ。周期表の横の列を周期(period)と呼び、周期の番号は電子殻の数と一致する。
- ※ 関連: 『元素記号』。
「族」は、1族から18族までの、合計18個がある。「周期」は、1族から7族までが、現在(2013年に本文を執筆。)では確認されている。 具体例をいくつか挙げると、族については、水素HとリチウムLiとナトリウムNaとカリウムKは、ともに1族の元素である。周期に関しては、水素Hは第一周期であり、リチウムLiは第二周期であり、Naは第三周期である。 他の族の元素でも、例を挙げる。酸素Oは、16族で第二周期の元素である。炭素Cは14族で第2周期である。塩素Clは17族元素で第3周期である。
族が同じ元素どうしを同族元素という。たとえば、HとLiとNaとKとルビジウムRbとセシウムCsとフランシウムFrとは、お互いに同族元素である。 他の族でも例を挙げれば、14族の炭素Cと,シリコンSi,ゲルマニウムGeと,すずSnと,鉛Pbとは、お互いに同族元素である。

ロシアのメンデレーエフによって、1869年に、周期表が作られはじめた。彼メンデレーエフの偉大な点は、当時知られていた63種類の元素だけを並べようとはせず、空欄がいくつもある表をつくったことであり、その空欄には未知の元素が入ると予言したことである。
- (※ 教科書の範囲外: )じつはメンデレーエフ以前にも元素を並べようとしていた先駆者はいたが、しかし彼ら先駆者は既存の元素だけで無理に並べようとしたりしたので、注目されなかった。(※ 参考書のチャート式に書いてあるメンデレーエフ以前の発見者の説明は、そういう意味。)
メンデレーエフは、まず元素を原子量の順に並べると、化学反応などの性質の似た元素が表の縦の列にあらわれるような周期表を作成した。当時に、まだ知られていない元素があったが、それは、「未発見の元素があるのだろう」とメンデレーエフは考えた。のちに、メンデレーエフの予想したとおりの性質をもつガリウムやゲルマニウムが発見された。
発見されたゲルマニウムの性質は、メンデレーエフの予言したエカケイ素とよく一致した。エカケイ素は、彼の周期表で、ケイ素の一つ下にある元素である。(エカとはサンスクリット語で「1」の意味。)
| エカケイ素 Es | ゲルマニウム Ge | |
|---|---|---|
| 原子量 | 72 | 72.6 |
| 密度[g/cm3] | 5.5 | 5.3 |
| 融点 | 高い | 937 |
| 酸化物 | EsO2 | GeO2 |
- ※ wikiの仕様上、コラム内で表を描けないので、コラム外に表を記述しています。
- アルカリ金属
1族の同族元素のうち、水素Hを除いた残りの元素の、LiとNaとKとルビジウムRbとセシウムCsとフランシウムFrを、アルカリ金属(alkali metals)という。Hはアルカリ金属には含めない。
- アルカリ土類金属
2族元素のうち、ベリリウムBeとマグネシウムMgを除いた残りの元素の、カルシウムCa,ストロンチウムSr,バリウムBa,ラジウムRaをアルカリ土類金属(alkaline earth metal)という。ベリリウムBeとマグネシウムMgはアルカリ土類金属には含めない。
- ハロゲン元素
17族の元素のフッ素F,塩素Cl,臭素Br,ヨウ素I,アスタチンAtをハロゲン元素(halogen)という。
- 希ガス元素
18族のヘリウムHe,ネオンNe,アルゴンAr,クリプトンKr,キセノンXe,ラドンRnを希ガス元素(rare gas)という。
- 遷移金属
3族から11族の元素を遷移金属(せんいきんぞく,transition metals)という。 遷移金属は、価電子の数が1個または2個であることが多く、族と価電子数が一致しない。
- 典型元素
遷移金属以外の元素である元素はどうだろうか。1族と2族と12族~18族の元素を典型元素(main group element)という。典型元素では、族の番号の1の位の数が、最外殻電子の数と一致する。
1族の元素と2族の元素は陽イオンになりやすい。 17族の元素は陰イオンになりやすい。 18族の元素は化合物をつくりづらい。天然には単分子で存在するのが一般である。
なお書式について、原子番号の個数をaとして核子の個数をbとして元素記号(HやHeなど)をAすれば、その原子を A のように書く事がある。
- 備考
カルシウムは、じつは金属である。カルシウムは金属なので、電気もよく通す。なのに、まったく骨が「電気を通す」という話を聞かない理由は、じつは動物の骨のおもな成分は、リン酸カルシウムという化合物であるので、電気を通しにくいのである。ちなみに骨は細胞である。
- ^ John McMurry ほか原著『第4版(原書7版) マクマリー生物有機化学 基礎化学編』、菅原二三男 監訳、平成25年1月25日 発行、p46
- ^ https://www.jstage.jst.go.jp/article/bunsekikagaku1952/12/1/12_1_91/_pdf 『講座 同位体の分離』理化学研究所 中根]