高等学校化学I/電池と電気分解
イオン化傾向
[編集]いくつかの金属は、酸の溶液に入れたとき、陽イオンになりやすい。
金属元素の単体を水または水溶液に入れたときの、陽イオンへのなりやすさをイオン化傾向(ionization tendency)という。 例として、亜鉛Znを希塩酸HClの水溶液に入れると、亜鉛Znは溶け、また亜鉛は電子を失ってZn2+になる。
- Zn + 2H+ → Zn2+ + H2
いっぽう、銀Agを希塩酸に入れても反応は起こらない。
このように金属のイオン化傾向の大きさは、物質ごとに大きさが異なる。
とりあえず、イオン化傾向の大きさを数式で表すと、
- Zn > Ag
である。
さて、銅を希塩酸の溶液に入れても、なにも反応しない。なので、
- Zn > Cu
である。
さて、銅と銀のイオン化傾向の大きさの大小関係は、以上の実験だけでは不明である。
なお、金属から放出された電子は、周囲の物質が受け取る。さきほどの亜鉛の陽イオン化の例の場合、周囲の水素イオンが電子を受け取り、水素になっている。
銅と銀のイオン化傾向
[編集]- 硝酸銀溶液と銅の場合
そこで、銅と銀のイオン化傾向を比べるための実験例として、硝酸銀AgNO3の溶液に、銅線や銅板などの銅の固体を添加する。ここでは、銅板を添加したとしよう。すると、銅板の表面に銀が付着し、銀が析出する。いっぽう、この硝酸銀の溶液中では銅板は陽イオンとなり溶ける。溶液は、しだいに青くなるが、この青色は銅イオン溶液の色である。 以上の変化を反応式で書くと、
- Cu + 2Ag+ → Cu 2+ + 2Ag
なお、この反応で生じた銀を、生じ方が樹木が伸びるように析出した銀が伸びることから銀樹(ぎんじゅ)という。
- 硫酸銅溶液と銀の場合
いっぽう、今度は溶液を変え、硫酸銅 CuSO4 の溶液に銀板Agをいれても、なにも析出せず、なにも変化は起きない。
これらのことから、銅は銀よりもイオン化傾向が大きいであろうことが予測できる。
つまり、イオン化傾向の大きさの予想で、
- Cu > Ag
が予想できる。
亜鉛と銅のイオン化傾向
[編集]また溶液を変え、硫酸銅の水溶液に亜鉛板Znを添加すると、亜鉛の表面に銅が析出する。このことから、亜鉛Znは銅Cuよりもイオン化傾向が大きいことが予想できる。
つまり、イオン化傾向の大きさの予想で、
- Zn > Cu
が予想できる。
イオン化列と反応性
[編集]イオン化列
[編集]さまざまな溶液や金属の組み合わせで、イオン化傾向の比較の実験を行った結果、イオン化傾向の大きさが決定された。 左から順に、イオン化傾向の大きい金属を並べると、以下のようになる。
- K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > (H2) > Cu > Hg > Ag > Pt > Au
金属を、イオン化傾向の大きさの順に並べたものを金属のイオン化列という。 水素は金属では無いが比較のため、イオン化列に加えられる。 金属原子は、上記の他にもあるが、高校化学では上記の金属のみのイオン化列を用いることが多い。 イオン化列の記憶のための語呂合わせとして、
「貸そうかな、まあ、あてにすな、ひどすぎる借金。」
などのような語呂合わせがある。ちなみにこの語呂合わせの場合、
「Kか そう かCa なNa、まMg あAl、あZn てFe にNi す なPb、ひH2 どCu すHg ぎAg る 借金Pt,Au。」
と対応している。
| イオン化列 | K | Ca | Na | Mg | Al | Zn | Fe | Ni | Sn | Pb | (H2) | Cu | Hg | Ag | Pt | Au |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 空気中での反応 | 速やかに酸化 | 表面に酸化皮膜 | 酸化されない。 | |||||||||||||
| 水との反応 | 常温で反応して水素を発生。 | 高温の水蒸気と反応 | 反応しない。
| |||||||||||||
| 酸との反応 | 塩酸、希硫酸と反応して水素を発生する。 | 酸化力の強い酸(HNO3など)に溶ける。 | 王水にのみ溶ける。 | |||||||||||||
酸素との反応性
[編集]イオン化傾向の大きい金属の溶解も、酸化の現象も、ともに物質からの電子の放出の現象であるように、一般にイオン化傾向が大きい金属ほど、酸化をされやすい金属である。 実際にK、Ca、Naの純物質の表面は、空気中ではすぐに酸化をして金属光沢を失い、放置すると内部まで酸化をする。
Mg、Al、Fe、Cuなどは、空気中に放置すると、やがて表面に酸化物の皮膜を生じる。酸化物の皮膜の化学式はそれぞれ、MgO 、Al2O3 、Fe2O3 、Cu2O、CuO などである。
水との反応
[編集]水との反応と、イオン化傾向との関係については、アルカリ金属やアルカリ土類金属のK , Ca , Naとは、常温で水と激しく反応し、水酸化物を生じ、また、水素を発生する。
マグネシウム Mg は常温の水とは反応しづらく、沸騰させた水にMgを入れた場合や、高温の水蒸気に Mg を作用させた場合には、反応して水酸化物および水素を発生する。
- Mg + 2H2O → Mg(OH)2 + H2
Al、Zn、Feでは、金属を加熱した状態で、高温の水蒸気を作用させると反応が起こり、酸化物および水素を発生する。反応後の生じる物質は、「水酸化物」では無く、「酸化物」なので注意。
- 2Al + 3H2O → Al2O3 + 3H2
- 3Fe + 4H2O → Fe 3O4 + 4H2
Niおよび、Niよりイオン化傾向の小さい金属は、水とは反応しない。
酸との反応
[編集]一般に、水素よりもイオン化傾向の大きい金属の単体は、希硫酸や塩酸などと反応し、酸のH+を還元するので水素を発生し、金属自身は陽イオンになる。
- (参考:イオン化列) K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > (H2) > Cu > Hg > Ag > Pt > Au
- Mgと酸
Mgは希塩酸とも強く反応し、水素を生じる。 (KやCaについては、溶媒の水そのものと激しく反応するので、ここでは考察対象から外される。)
- Al,Zn,Feと酸
Al,Zn,Feは希塩酸 HCl や希硫酸 H2SO4 とも反応し、水素を発生する。
- 2Al + 3H2O → Al2O3 + 3H2
- Zn + 2HCl → ZnCl2 + H2
- Fe + H2SO4 → FeSO4 + H2
- Pbと酸
Pbは希酸とは反応しない。
- Cu,Hg,Agと酸
Cu,Hg,Agは塩酸や希硫酸には溶けない。これらCuとHgとAgは、水素よりもイオン化傾向が小さい。これを溶かす酸には、硝酸HNO3か、熱した濃硫酸H2SO4が必要である。これらの酸(HNO3 あるいは H2SO4)は、強い酸化力をもつ。
- (濃硝酸) 3Cu + 8HNO3 → 3Cu( NO3 )2 + 2NO + 4H2O
- (希硝酸) Cu + 4HNO3 → Cu( NO3 )2 + 2NO2 + 2H2O
- (熱濃硫酸) Cu + 2H2SO4 → CuSO4 + 2H2O + 2SO2
これらの反応のとき、水素は発生せず、希硝酸では NO が発生し、濃硝酸では NO2 が発生し、硫酸では二酸化硫黄 SO2 が発生する。
- Pt,Auと酸
Pt,Auは硝酸や濃硫酸では溶けない。これを溶かす酸は、王水(おうすい、ラテン語: aqua regia)と呼ばれる、濃塩酸と濃硝酸の混合液を、体積比が塩酸3:硝酸1の体積割合で混合した混合酸で溶ける。王水は酸化作用がきわめて強い。
- Al,Fe,Niの不動態
Al,Fe,Niは濃硝酸には溶けない。濃硝酸にひたすと、表面が反応し、緻密な酸化膜が表面にでき、内部にまでは反応が進行しなくなる。このような状態を不動態(ふどうたい)という。
電池の仕組み
[編集]二種類の金属単体を電解質水溶液に入れると電池ができる。これはイオン化傾向(単体の金属の原子が水または水溶液中で電子を放出して陽イオンになる性質)が大きい金属が電子を放出して陽イオンとなって溶け、イオン化傾向の小さい金属が析出するためである。
電子の流れ出す側の電極の金属を負極(ふきょく、negative electrode)という。電子を受け取る側の金属の電極を正極(せいきょく、positive electrode)という。
この「正」と「負」は、(電極どうしをつないだ)銅線を基準に考えた視点である。
通常、イオン化傾向の大きい方の金属が負極になる。一方、イオン化傾向の小さい方の金属が正極になる。
なぜなら、イオン化傾向の大きい金属のほうが、陽イオンになって溶け出す結果、金属板には残された電子が多く蓄積するので、もし両方の金属板を銅線でつなげば、イオン化傾向の大きい方から小さい方に電子は流れる。「電流」では無く、「電子」としていることに注意。電子は負電荷であるので、電流の流れと電子の流れは、逆向きになる。
電池の、正極と負極とのあいだに生じる電位差(でんいさ)を、起電力という。
電池の種類
[編集]ボルタ電池
[編集]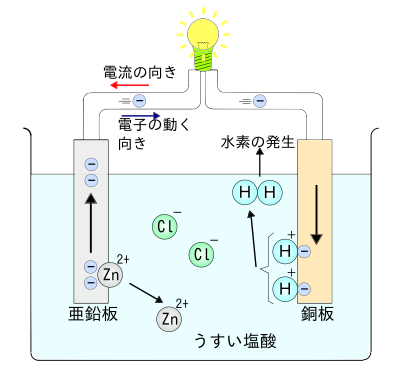
- 希硫酸 H2SO4 の中に亜鉛板Znと銅板Cuを入れたもの。
負極(亜鉛板)での反応
- Zn → Zn2+ + 2e-
正極(銅板)での反応
- 2H + + 2e- → H2↑
起電力
[編集]ボルタの電池では、得られる両極間の電位差(「電圧」ともいう。)は、1.1ボルトである。(単位のボルトはVと略して、1.1Vとも書く。)この両極板の電位差を起電力(きでんりょく、electromotive force, EMF)という。起電力は、両電極の金属の組み合わせによって決まる物質固有の値である。
電池と酸化還元との関係
[編集]ボルタの電池の亜鉛板で起きている反応は、電子を放出することから酸化反応である。また銅板で起きている反応は、電子を受けとっているので還元反応である。
電池図
[編集]ボルタ電池の構造を以下のような文字列に表した場合、このような表示を電池図あるいは電池式という。
- (-) Zn | H2SO4aq |Cu (+)
aqは水のことである。H2SO4aqと書いて、硫酸水溶液を表している。
関連事項
[編集]- 電気回路との関連事項
物理学の電気回路の研究では、このような電池などの現象の発見と発明によって、安定な直流電源を実験的に得られるようになり、直流電気回路の正確な実験が可能になった。電池の発明以前にも、フランス人の物理学者クーロンなどによる静電気による電気力学の研究などによって、電位差の概念や電荷の概念はあった。だが、この時代の電源は、主に静電気によるものだったので、安定電源では無かった。
そして、電池による安定な電源の発明は、同時に安定な電流の発明でもあった。このような電池の発明などによる、直流電気回路の研究などから、ドイツ人の物理学者オームが、さまざまな導体に電流を流す実験と理論研究を行うことにより、電気回路の理論のオームの法則(オームのほうそく、Ohm's law)が発見された。

じつはオームは電池ではなく熱電対(ねつでんつい)というものを使って、電気回路に安定した電流をながす研究をした。当時の電池では、起電力がしだいに減ってしまい、オームは当初は電池で実験したが、うまく安定電流を得られなかった。
熱電対とは、まず異なる金属材料の2本の金属線を接続して1つの回路をつくり、2つの接点に温度差を与えると、回路に電圧が発生するため電流が流れる(この現象を、ゼーベック効果という)。この現象じたいは、1821年にゼーベックが発見した。このような回路が、熱電対である。なお、同じ2本の金属線では、温度差を与えても電圧は発生せず、電流は流れない。
オームは、ベルリン大学教授ポッケンドルフの助言によって、この熱電対を実験に利用した。温度を安定させるのは、当時の技術でも比較的簡単であったので、こうしてオームは安定電流をもちいる実験ができたのである。
- ※ 熱電対については、高校の範囲を超えるし、大学入試にも出題されないだろうし、大学の授業でもあまり深入りしないので、分からなければ、気にしなくてよい。
- オームの法則との関連事項
オームの法則とは、
「ほとんどの導体では、電流 I が流れている導体中の2点の点 と点 間の電位差 は、電流 I に比例する。」
という実験法則である。 誤解されやすいが、オームの法則は、このような実験法則であって、べつに抵抗の定義式では無い。同様に、オームの法則は、べつに電圧の定義式では無いし、電流の定義式でも無い。中学校の理科での電気回路の教育では、金属の電気分解の起電力の教育まではしないので、ともすれば、電圧を誤解して、「電圧は、単なる電流の比例量で、抵抗はその比例係数」のような誤解する場合が有りうるが、その解釈は明らかに誤解である。 また、半導体などの一部の材料では、電流が増え材料の温度が上昇すると抵抗が下がる現象が知られているので、半導体ではオームの法則が成り立たない場合がある。なので、オームの法則を定義式と考えるのは不合理である。 詳しくは物理の教科書を参考にせよ。
- 電気における物理と化学の関連事項
以上のような物理との関連事項の説明から分かるように、この電気化学の分野は、物理科目の電気分野との関連がある。物理の電気分野の理解を深めるには、電気化学の知識が必要だし、また電気化学の理解を深めるにも物理の電気分野の知識が必要である。このように物理と化学の知識がともに必要としあうのは、べつに電気の分野に関わらない。気体と熱・温度の分野でも同様に物理の知識と化学の知識が共に必要になるし、他にもいろいろとある。なので、化学を学習する際には、併行して物理も学習するのが望ましい。大学での化学科の科目では「物理化学」という物理学の知識を用いて化学反応を研究する科目があるくらいである。
分極
[編集]ボルタ電池では、正極の銅板で発生する水素が銅板を包むので、銅板と溶媒とのあいだの電子の移動が妨げられる分極(ぶんきょく、polarization)が起きる。このような分極を防ぐために酸化剤を溶液に加える。この分極を防ぐ目的で加える酸化剤を減極剤(げんきょくざい、depolarizer)という。減極剤としては過酸化水素水 H2O2,またはMnO2,またはPbO2を使用する。
ダニエル電池
[編集]ダニエル電池(Daniell cell)とは、亜鉛板Znを入れたZnSO4水溶液と、銅板Cuを入れたCuSO4水溶液を、両方の溶液が混ざらないようにセロハンや素焼き板(溶液は混合しないがイオンは通過できる)で区切ってできる電池。セロハンや素焼き板の間をSO42-が亜鉛板側に移動する。CuSO4水溶液は濃く、ZnSO4水溶液は薄い方がよい(Znの溶出が進み、Cuの析出が進む方向)。
陽極(負極)での反応
- Zn → Zn2+ + 2e-
陰極(正極)での反応
- Cu2 + 2e- → Cu
電池図
- (-) Zn| ZnSO4aq | CuSO4aq |Cu (+)
起電力:1.1ボルト
乾電池
[編集]
1.正極端子 2.集電体(炭素棒) 3.負極(亜鉛) 4.正極(二酸化マンガン) 5.電解液(塩化亜鉛・塩化アンモニウム) 6.負極端子
電池の電解液は、文字通り「液体」なので、そのままでは持ち運びに不便である。そこで、改善策としてなんらかの方法で、電解液を固体状に固める発想が出てきた。
電解質溶液に添加物を加えて、電解質をペースト状にかためた電池を乾電池(dry cell)という。
代表的な乾電池としてマンガンを用いたマンガン乾電池(zinc–carbon battery)がある。
- マンガン乾電池
電池図は、
- (-) Zn | ZnCl2aq, NH4Claq | MnO2,C (+)
である。
反応式は、負極では亜鉛が以下のように反応して溶け出る。
正極の炭素棒は電子を媒介するだけで、炭素そのものは反応しない。電子を受け取るのはMnO2である。
鉛蓄電池
[編集]
ボルタの電池や乾電池は、使用していると、だんだん起電力が低下してしまい、もとには戻らない。 そして、いつかは起電力が無くなる。このような使った分は戻らない電池を一次電池(primary cell)という。 いっぽう、ダニエル電池や、鉛蓄電池という電池は、外部から電気を与えることで元に戻すことができる。 電池を元の状態へと回復させる場合には、外部電源により、電池の放電時とは逆向きに電流を流す。このようにして、消費した電池をもとの状態に戻すことを充電(じゅうでん、charge)という。 充電により繰り返して使用ができる電池を蓄電池あるいは二次電池(secondary cell)という。 充電によって、元に戻る理由は、放電時との逆反応が起こるからである。
ボルタ電池では、正極で発生した水素は空気中に散逸するので、逆電圧を加えても放電時の逆反応を起こす物質がないため、逆反応ができない。
充電の用語に対して、いっぽう、電池を使用している状態を放電(ほうでん、discharge ディスチャージ)という。
鉛電池の電池図は、
- (-) Pb | H2SO4aq | PbO2 (+)
起電力は電極1組あたり、約2.1Vである。(実際の製品では、容器内に複数組の電池が直列または並列になっている。)
放電時の反応は、
負極(-)では
がおこり、正極(+)では、
がおこる。正極の負極がともに硫化されていることから分かるように、放電によって、電解液である硫酸は消費され、硫酸の濃度は低下していく。
鉛蓄電池の実用例として、自動車のバッテリとして、よく用いられている。
- 鉛蓄電池の充電
充電時の場合は、以下の反応が起こる。
負極(-)では
がおこり、正極(+)では、
というふうに、逆反応がおこる。
- まとめ
鉛電池は希硫酸中にPbとPbO2を極板として入れた電池。
陽極(負極)での反応
- Pb + SO42- → PbSO4 + 2e-
陰極(正極)での反応
- PbO2 + 4H+ + 2e- + SO42- → PbSO4 + 2H2O
電池図
- (-) Pb|H2SO4|PbO2 (+)
起電力:2.1ボルト
※ 参考: その他の実用電池
[編集]- ※ 検定教科書でも参考書(チャート式)でもコラム扱い。(入試には出るかもしれないが。)
実用電池には上述した乾電池や鉛蓄電池の他にも、さまざまな電池があるが、イオン化傾向を利用しているということなどの基本的な仕組みは、あまり変わらない。 その他の実用されている化学電池には、
- アルカリマンガン電池
- 銀電池
- リチウム電池
- ニッケルカドミウム電池
- 燃料電池
などがある。なお、太陽電池は化学電池では無い。太陽電池は、物理電池(ぶつり でんち)として分類する。(物理電池の用語については、覚えなくてよい。)
- ※ 太陽電池については、物理 IまたはII の半導体の単元で習うだろう。
| 名称 | 電池の構成 | 起電力 | ||
|---|---|---|---|---|
| 負極 | 電解質 | 正極 | ||
| マンガン電池 | Zn | ZnCl4, NH4Cl | MnO2 | 1.5 V |
| アルカリマンガン乾電池 | Zn | KOH | MnO2 | 1.5 V |
| リチウム電池 | Li | 有機電解質 | MnO2 など | 3.0 V |
| 銀電池 | Zn | KOH | Ag2O | 1.55 V |
| 空気亜鉛電池 (空気電池) |
Zn | KOH | O2 | 1.4 V |
| 名称 | 電池の構成 | 起電力 | ||
|---|---|---|---|---|
| 負極 | 電解質 | 正極 | ||
| 鉛蓄電池 | Pb | H2SO4 | PbO2 | 2.0 V |
| ニッケル・カドミウム電池 | Cd | KOH | NiO(OH) | 1.2 V |
| ニッケル水素電池 | MH (水素吸蔵合金) |
KOH | NiO(OH) | 1.2 V |
| リチウムイオン電池 | Liをふくむ黒鉛 | リチウム塩 | LiCoO2 | 3.7 V |
- アルカリマンガン電池
- 負極: Zn
- 電解液: KOH水溶液
- 正極: MnO2
- 起電力: 1.5V
- 銀電池
- 負極: Zn
- 電解液: KOH水溶液
- 正極: Ag2O
- 起電力: 1.55V
- 一次電池
銀電池は電圧が安定しているため、時計や電子体温計などに用いられる場合が多い。
- リチウム電池
- 負極: Li
- 電解液: LiClO4 および有機溶媒
- 正極: (CF)n
- 起電力: 3.0V
- 一次電池
リチウムは水と反応するので、電解質に水を使うことができない。このため、エチレンカーボネートなどの有機物を電解に用いる。
リチウム電池は長寿命のため、時計や電卓、心臓用ペースメーカなどに用いられている。
- 空気電池
- 一次電池
空気電池は軽量なので、よく補聴器に用いられている。購入時には、空気の侵入をふせぐシールが貼られている。使用し始める際には、シールをはがす。シールをはがすと放電が始まる。はがしたシールを貼り直しても、保存は効かない。
- リチウムイオン電池
- 負極: Liと黒鉛Cの化合物
- 電解液: リチウム塩および有機溶媒
- 正極: コバルト酸リチウム LiCoO2
- 起電力: 約 4V
- ニ次電池
リチウムイオン電池は軽く、電気の容量も大きいので、携帯電話やノートパソコンなどの充電池として利用されている。
- ニッケルカドミウム電池
- 負極: Cd
- 電解液: KOH水溶液
- 正極: オキシ水酸化ニッケル NiO(OH)
- 起電力: 1.2V
- ニ次電池
ニッケルカドミウム電池は電動工具などによく利用されている。カドミウムの有害性の問題があるので、生産量は減少しており、代替品としてニッケル水素電池に置き換えられていっている。
- ニッケル水素電池
- 負極: 水素吸蔵合金(MH)
- 電解液: KOH水溶液
- 正極: オキシ水酸化ニッケル NiO(OH)
- 起電力: 1.3V
- ニ次電池
負極の水素吸蔵合金は、結晶格子の間に水素を取り込め、必要に応じて取り込んだ水素を放出できる。ニッケル水素電池は自動車のハイブリッドカーのバッテリーに用いられる。なお、水素記号のことを記号でMHと表す場合もある。
- 燃料電池

左側から供給された水素 H2 の一部は、正極でイオン化され、負極にたどり着き、酸素 O2 と反応し水になる。
anode = 陰極 , cathode = 正極 , Fuel = 燃料 , electrolyte = 電解質 .
水素などの陽極の燃料を、触媒を用いてイオン化させ、余った電子を取り出す電池。陽極の燃料が水素の場合は、陰極で酸素および回収した電子と反応し水になる。 様々な方式の燃料電池がある。
リン酸型燃料電池の場合、
- (ー)H2|H3PO4aq|O2(+)
電解質にリン酸水溶液を用いている。負極に水素を供給する必要があり、正極に酸素を供給する必要のある電池である。 負極で起きる反応は、
- (負極) 2H2 → 4H+ +4e-
である。負極で生じた水素イオンが電解質を移動し、反対側の正極にまで達し、つぎの反応が起きる。
- (正極) O2 + 4H+ +4e- → 2H2O
つまり、水素イオンが酸素によって酸化したわけである。つまり、水素イオンが燃焼したわけである。
この方式の燃料電池の反応式については、高校生はとりあえず、負極で水素が反応して水素イオンが発生することを、覚えておけばよい。そして、正極では酸素と反応して水が生じることを覚えておけばよい。
起電力は約1.2V(1.2ボルト)である。このリン酸型燃料電池は、酸素の酸化によって生じたエネルギーの一部を、電気エネルギーにしている装置として、解釈できる。
水の電気分解の、逆の原理であると、解釈してよい。
なお、正極と負極は多孔質になっており、水素や酸素を通過させられるようになっている。
この燃料電池の生成物が水なので、環境にやさしいと考えられおり、開発が進められており、一部は実用化もしている。
また、反応源の水素を発生するためにも、電気分解などの電力エネルギーなど、なんらかのエネルギーが必要なことから、この電池は、水素のエネルギーを電気エネルギーに変換している装置として、解釈もできる。
なお、アメリカのアポロ宇宙船に用いられた燃料電池はアルカリ型の方式のものであり、リン酸型ではない。
アルカリ型燃料電池とは、電解質に水酸化カリウム KOH などを用いる方式である。
- (ー)H2|KOHaq|O2(+)
他に、固体高分子型や固体酸化物型などがある。
電気分解
[編集]電解質の水溶液に、電極を2本入れて、それぞれの電極に、外部の直流電源から電気を通じると、各電極で水溶液中の物質に化学反応を起こせる。これを電気分解という。
電気分解で、直流電源の負極につないだ側の電極を陰極(いんきょく)という。 電気分解で、直流電源の正極につないだ側の電極を陽極(ようきょく)という。
陰極の電荷は、電源の負極から電子が送られてくるので、陰極は負電荷に帯電する。いっぽう、陽極の電荷は、正電荷に帯電する。
なお、電気分解の電極には、化学的に安定な白金 Pt や炭素 C などを用いる。
電気分解のさい、陽極では酸化反応が起こり、陰極では還元反応が起こる。
一般に電気分解で反応を起こしたい対象は「水溶液」であり、電極そのものは反応を起こしたい対象ではないので、混同しないように注意のこと。外部の文献などでは、説明の簡略化のため、電気分解では「電極での反応」などという事が多いが、電極そのものが析出をするのでは無いので、間違えないように。
この電気分解の実用例として、金属の精錬に利用されている。
電気分解の反応
[編集]陰極での反応
[編集]さて、水溶液の電気分解では、水溶液中で、もっとも還元されやすい物質が電子を受け取り、還元反応が起こる。
- ・ なので、Cu2+、Ag+などのイオン化傾向の小さい金属イオンが溶けていれば、これらの金属が析出する。
- ・ K2+、Na+などのイオン化傾向の大きい金属イオンしか溶けてない場合、かわりにH2Oが還元されるため水素H2が発生する。
陽極での反応
[編集]- ・ Cl-、I-などハロゲン化物があれば、ハロゲン化物は酸化されやすいため、これらのハロゲン化物が酸化されてCl2、I2などが発生する。
- ・ SO42-、NO3-などは酸化されにくいため、かわりにH2Oが還元されるため酸素O2が発生する。
- ・ 塩基性溶液では、OH-が酸化されてO2が発生する。
- ・ 白金や炭素以外の物質を陽極にした場合、陽極じたいが酸化されて溶け出す。
塩化銅水溶液の電気分解
[編集]電極には、炭素電極または白金 Pt を用いる。塩化銅CuCl2水溶液では、陰極付近の水溶液では、電源から電子が送られてくるので以下の還元反応が起こり、陰極からは銅が析出する。
- 陰極: Cu+ + 2e- → Cu
陽極では、電源へ電子が奪われるので、以下の酸化反応が起こり、陽極からは塩素が発生する。
- 陽極: 2Cl- → Cl2 + 2e-
硫酸銅(II)水溶液の電気分解
[編集]電極には、白金 Pt を用いるとする。硫酸銅 CuSO4 水溶液。
- 陰極: Cu2 + 2e- → Cu
陰極での反応は還元反応である。
- 陽極: 2H2O → O2 + 4H+ + 4e-
陽極での反応は酸化反応である。
この硫酸銅での電気分解の現象は、銅の電気精錬に応用されている。
水の電気分解
[編集]純水な水は電気を通さないので、導電性を高めるために硫酸か水酸化ナトリウムを加える。
- 水酸化ナトリウムを加えた場合
H2とNaのイオン化傾向を比べた場合、Na>H2なので、陰極で還元されるのは水素イオンH+である。
- 陰極: 2H+ + 2e- → H2↑
陰極では、水素H2が発生。
- 陽極: O2が発生。
電気分解の実用例
[編集]水酸化ナトリウムの製造
[編集]- ※ 教科書の範囲内。『化学基礎』科目で習う場合も多い。
工業的に水酸化ナトリウムの作る際に、イオン交換膜をもちいて設備で、食塩水を電気分解する方法が利用されている。
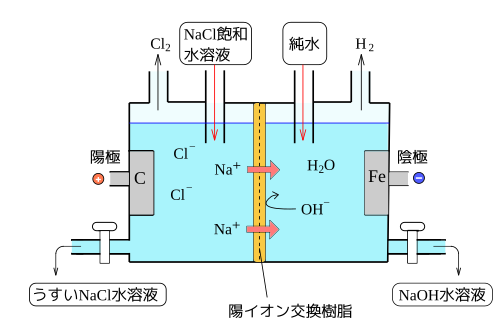
(※ この反応で陰極側に加える液体は、図では「純水」としてあるが、実際は導電性をもたせるために、うすめの水酸化ナトリウムを加える。検定教科書では「純水」と表記してある教科書もあるので、高校生は、気にしなくて良い。)
図のように陽イオン交換膜による隔壁でへだてて片方に陽極、もう片方に陰極の電極を配置する。 そして、陽極側にNaCl水溶液を入れる。電圧をなにも加えて無い状体では、NaイオンとClイオンに分離している。
そして電圧を加えると、電気分解が起きる。
陰極では
- (還元)
陽極では
- (酸化)
という反応が起きる。
その結果、Cl-イオンが発生する。このCl-イオンは陽イオン交換膜を通れず、Cl-イオンはそのまま陽極側にとどまる。そしてCl-イオンは陽極のプラス電荷を受け取って塩素ガスになり気体となって排出される。
いっぽうで、Na+イオンはそのまま水溶液中にとどまり、また陽イオン交換膜を通過する。
いっぽう陰極側ではOH-は陽イオン交換膜を通過できないので、そのまま陰極側にとどまる。また、水素イオンH+は陰極で電荷を受け取り、水素ガスを発生して、排出される。
こうして、陰極側の溶液ではNa+イオンとOH-イオンばかりになる。
Naはイオン化傾向が水よりも大きいので、陰極ではNa+はイオンのままである。なので陰極では水H2Oだけが還元されてOH-ができる。
こうして、陰極ではNaOHの濃度の高い水溶液が得られる。この水溶液を濃縮することによって、水酸化ナトリウムNaOHが得られる。
- 備考
現在、日本で工業的に水酸化ナトリウムを生産する方法は、イオン交換膜法である。
- ※ なお「アンモニアソーダ法」は炭酸水素ナトリウムの製法である。混同しないように。
- 隔膜法
以前は、アスベストなどをもちいた「隔膜法」(かくまくほう)が用いられていた。この隔膜法も、電気分解を用いる。濃い食塩水(塩化ナトリウム水溶液)を電気分解する方法で水酸化ナトリウムは生産できる。電気分解したときに、塩素の気体が発生するので、気体を排出することにより、溶液中にNa+イオンを多くさせている。
なお、陽イオン交換膜をもちいた方法とは違い、隔膜法の隔膜では塩素イオンも通過してしまうので、この方法では、得られる水溶液に不純物としてNaClが混ざる。
またなお、陽極は炭素Cである。陰極は鉄網Feである。隔膜の外部を鉄網で覆っている。
陽極では
陰極では
という反応が起きる。Naはイオン化傾向が水よりも大きいので、水が還元されてOH-ができる。
陰極で発生したOH-によってNaOHができるが、そのままだと陽極のCl2と反応してしまいNaClになってしまうので、NaとClとを結合させず隔離するために、隔膜としてアスベスト(「石綿」ともいう。)などでつくった多孔質の膜を用いる。アスベストは人体に有害である。
- 水銀法
昔の水酸化ナトリウムの製法では、水銀をもちいた水銀法という生産方法もあったが、水銀の有毒性に対する環境保護政策のため、現在(2013年)では日本での水酸化ナトリウムの工業生産では、水銀法は用いていない。
なお、水酸化ナトリウムのことを苛性ソーダ(かせいソーダ)ともいうので、自主調査する場合は、この呼び方も参考に。
銅の精錬
[編集]
銅の鉱石を、コークスCなどとの加熱反応で還元したものは、純度が約99%で、粗銅(そどう)とよばれる。粗銅には、亜鉛や銀などの不純物が含まれるので、純度をあげためには、これら亜鉛などを分離する必要があり、そのために電解が利用されている。
硫酸銅(II)水溶液をもちいる。そのさいの電極(陽極)に、純度をあげたい銅を用いる。つまり、粗銅を陽極に用いる。純度の高い銅を陰極に用いる。電気分解により、次の反応が起こる。
- 陰極: Cu2 + 2e- → Cu
- 陽極: Cu → Cu2 + 2e-
陽極からは、銅だけが溶け出すのではなく、イオン化傾向の大きい鉄や亜鉛やニッケルなども溶け出す。しかし陰極で析出するのは、ほとんど銅だけなので、よって陰極にて高純度の銅が得られる、という仕組みである。
粗銅中に銀や金が含まれていた場合、イオン化傾向が銅よりも小さい銀や金は、陽極の下に沈殿する。これを陽極泥(ようきょくでい、anode slime)という。陽極泥には、金や銀などが含まれているので、ここから金や銀を回収する。
陰極には純度の高い純度99.99%程度の銅が析出する。これを純銅(じゅんどう)という。
融解塩の電解
[編集]アルミニウムやマグネシウムやアルカリ金属やアルカリ土類金属はイオン化傾向が大きいため、そのイオンをふくむ溶液を電気分解しても、アルミニウムなどの単体は得られない。そこで、イオン化傾向の大きい金属を電気分解で得たいときは、塩や酸化物を融解し、これを電気分解することで単体を得る。このような方法を、溶融塩電解(ようゆうえん でんかい)という。
アルミニウムの精錬
[編集]酸化アルミニウムAl2O3の電気分解によって、アルミニウムが得られる。
酸化アルミニウムAl2O3じたいは、鉱石のボーキサイト(Al2O3・nH2O)から、つくられる。そのボーキサイトからの酸化アルミニウムのつくりかたの説明は省略する(検定教科書でも、くわしい説明は省略)。Al2O3は、アルミナとも呼ばれる。
アルミニウムを得たい場合、アルミナAl2O3は融点 2072 °Cと非常に高いため、そのままでは融解させづらい。そこで融点を下げるため、氷晶石Na3 AlF6(融点 1012℃)を、割合が氷晶石9.5重量%ほど加えると、溶融温度が下がり、融点が約970℃になる。これを炭素電極によって電気分解によって、陰極で、アルミニウムができる。
陽極では、電極の炭素が空気中の酸素と反応して、COやCO2ができる。
- (陰極) Al3+ + 3e- → Al
この一連のアルミニウムの電解方法をホール・エルー法(ホール・エルーほう、Hall-Héroult process)という。名前の由来は発明者であるアメリカ人ホールとフランス人エルーである。
- ※ 化学Ⅱで金属の精錬を扱う。
電気分解と電気量との関係
[編集]単位の定義
[編集]- クーロン
1A(アンペア)の電流が1秒間、流れこんで貯まったときの電気量を1クーロンという。記号はCであり、1クーロンは1Cと書く。 このアンペアに基づく定義は、現在(西暦2013年)での、1クーロンの定義である。
電気量をQ[C]とすると、電流i[A]で時間t秒の電流を流した場合は、Q[C]とi[A]とt[S]の関係は、
- Q = i × t
である。
- ファラデー定数
1molの数の価電子がもつ電荷は約96500 Cであることが実験的に確認されている。そこで、この96500 C/mol をファラデー定数(ファラデーていすう、英: Faraday constant)という。記号はFで表す。1F = 96500 C/mol である。
また、別の科学者の実験により(物理学者ミリカン(人名)による油滴の帯電の静電気力の測定実験など)、 電子1個のもつ電子の電荷の大きさも分かっており 電子1個の電荷は 1.60×10-9 [C]である。
普通、数式では電荷の文字はeで表すので、
- e = 1.60×10-9 [C]
である。
計算を実際にしてみると、電子1個の電荷に、1モルぶんの粒子の個数を掛け算したものは、下記のように、たしかにファラデー定数に近い数字になる。
である。 電気素量に1molも個数6.02×1024をかけると、約96500になる。(読者は計算して、これを確かめよ。)
また、この計算の事実は、価電子が確かに電子であることとみなすことの妥当性も実証している。
なお電子1個のもつ電荷の大きさ e = 1.60×10-9 [C] のことを電気素量(でんき そりょう)という。
ファラデーの電気分解の法則
[編集]- 電気分解によって、電極で変化する物質量は、与えた電気量に比例する。
- 電気分解によって、価数の異なる物質の変化を比べた場合、同じ電気量で変化する物質量は物質の価数に反比例する。あるいは物質の(1/価数)に比例する。
この法則を、電気分解におけるファラデーの法則という。あるいは単にファラデーの法則という。
- 例1
AgNO3の電気分解では、電流1Fで物質量1molのAgが析出する。なぜなら、Agは1価であり、反応式は
のように反応するからである。
- 例2
CuSO4の電気分解では、電流1Fで0.5molのCuが析出する。なぜなら、Cuは2価であり、反応式は
のように反応するから、銅を1分子ほど析出させるのに電子が2個ほど必要だからである。
- 例3
H2SO4の電気分解では、電流1Fで0.5molのH2が発生する。反応式は
のように反応するから、水素H2を1分子ほど発生させるのに電子が2個ほど必要だからである。
これ等の例のように、発生物の物質量を求める場合の手順は、
- まず反応式を書いてから、
- その式での、電子eの係数と生成物の係数との比を元に、発生物の物質量を計算する。
というふうに計算する。
亜鉛めっき
[編集]鉄の腐食を防ぐ目的で鉄の表面に亜鉛Znの薄膜をつけることがある。 これはイオン化傾向が亜鉛のほうが大きいので、腐食するときは亜鉛から腐食して、鉄の腐食が遅れるからである。 このような金属の表面に別の金属をつけることをめっき(鍍金)という。 鉄板や鋼板を亜鉛Znでめっきしたものをトタンという。
なお、めっきには他にもすずめっき(ブリキ)や金めっきや銀めっき、クロムめっきなどがある。他のめっきは、必ずしもイオン化傾向を利用して腐食を防ぐとは限らない。
さびを防ぐ、その他の手法
[編集]範囲外: ペンキ塗装の目的と仕組み
[編集]- ※ 科目『科学と人間生活』で大まかな塗装の意義について習う。(数研出版の教科書など。)
- (※ ペンキ塗装そのものは、電気などは、べつに利用していないが、ついでに学ぼう。なお、ペンキは、メッキではない。混同しないように。)
さびを防ぐには、空気や水との接触をふせぐのが効果的である。このため、建築では、鉄の部分の壁には、塗装をする場合が多い。
建築物で外壁の板金にペンキ塗装をしてある家庭が多い。ペンキ塗装する本来の目的は、サビなどの腐食を防ぐ事が、おもな目的である。(※ ここまで『科学と人間生活で習う。』)
- ※ ときどき、「外壁の美観を向上する事だけがペンキ塗装の目的だ」というような勘違いしている、無知な大人がいる。
建築物で外壁の板金にペンキ塗装では、色のついた顔料の他にも、「上塗り」(うわぬり)および「下塗り」(したぬり)として樹脂製の塗料を塗っている。
ペンキで、外壁などに色をつける目的のひとつは、サビを防ぐための効果のある上塗り剤(うわぬりざい)・下塗り剤(したぬりざい)が年月の経過による劣化で落ちかけている場合に、目視で劣化を確認しやすくするための手段でもある。
- ※ 無知な人の中には、上塗り材を、単なるツヤ出し剤だと誤解している人もいる。
プロの塗装工によるペンキ塗装では、色のついた塗料を塗る工程の前後に、 まず色塗りの前の工程として、ペンキの付着を向上するため及び(および)耐腐食性をあげるための下塗り(したぬり)をしており、また、色塗りの後の工程としてペンキが風雨で落ちないようにするため及び耐腐食性を上げるための上塗り(うわぬり)をしており、この下塗りと上塗りによって、耐腐食性を上げている。
- ※ ときどき、自宅の外壁塗装の修繕(しゅうぜん)費用を安く済ませようとして、自分でペンキの顔料(色の部分)だけを購入して塗装をする人がときどき居るのだが、下塗りと上塗りの意味をしらずに、下塗りと上塗りの工程をはぶいてしまい、無駄な結果に終わってしまう人がいる。
- ※ きみたち高校生は、無知な勘違いをしている馬鹿な大人には、ならないように気をつけよう。
範囲外: ほうろう
[編集]- ※ 科目『科学と人間生活』で大まかな「ほうろう」の意義について習う。(第一学習社の教科書など。)
(建物ではないが、)装飾品などで、金属にガラスを焼き付けることで、空気や水がその金属に接触するのを防ぐ手法もよくある。
このような手法を、「ほうろう」という。(※ ここまで、第一学習社の教科書などで習う。)
じつは、(装飾品などの他にも、「ほうろう」の用途はあり、)化学工場などで、腐食性の高い薬液が、その薬液が中にあるタンクやパイプなどに接触するのを防ぐために、内壁にガラスを焼き付けたりしてあるタンクやパイプを使う場合もある。(※ 工業高校の一部の科目の教科書で、紹介されている。)





![{\displaystyle \mathrm {Zn^{2+}+4NH_{4}^{+}\rightarrow [Zn(NH_{3})_{4}]^{2+}+4H^{+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e38126052ee1c660b8349933aa52df4bcddd2df7)









