高等学校化学II/ゴム
天然ゴム
[編集]
ゴムノキの幹に傷をつけると、その木から白い樹液が取れるが、このゴムノキの白い樹液をラテックス(latex)という。このラテックスは白くて粘性がある。
ラテックスは疎水コロイド溶液であり、炭素にタンパク質が保護作用をした保護コロイドによるコロイド溶液である。
ラテックスに酢酸などの酸を加えて凝固させたものが天然ゴム(natural rubber)あるいは生ゴム(なまゴム,raw rubber)である。生ゴムの主成分はポリイソプレンであり、これはイソプレン C5H8(示性式はCH2=C(CH3)CH=CH2である。)が付加重合したものである。
生ゴムには、弾性はあるものの、生ゴムの弾性は弱い。ゴム材料に弾性を持たせるには、加硫(= 硫黄を添加して加熱する処理)という処理が必要である。

イソプレンの構造式を見ると、2箇所の二重結合の間に単結合がある部位がある。二重結合があるため、シス形とトランス形の二通りがあろうが、一般の生ゴムの場合はシス形ポリイソプレンである。
いっぽう、マレー半島などのアカテツ科の樹液からとれるグッタペルカは、トランス型のポリイソプレンである。グッタペルカは常温ではプラスチック結晶状の硬い固体である。50度以上の温度で柔らかくなる。
加硫
[編集]生ゴムに硫黄Sを数%加えて加熱すると、弾性が増す。この弾性の増したゴムを弾性ゴム(だんせいゴム、elastic rubber)や加硫ゴムと言い、この生ゴムに硫黄を加えて弾性ゴムを得る一連の操作を加硫(かりゅう、vulcanization、cure)という。

ポリイソプレンの2重結合の部分に硫黄原子Sが結合し、S原子は2個の原子と結合できるから、S原子が他の二重結合とも結びつき、S原子がポリイソプレンを橋架けして、(-S-S-)といった結合が生じるをする。このような高分子鎖などを橋架けをする反応を架橋結合(かきょう けつごう)または架橋(cross linkage)という。
加硫ゴムは、2重結合が減った結果、化学反応性が低下するので、耐薬品性が増す。
- エボナイト
生ゴムに30%~40%の硫黄を加硫して加熱した得られる黒色のかたいプラスチック状の物質をエボナイト(ebonite)という。
合成ゴム
[編集]天然以外に製造したイソプレンを架橋したゴムや、ブタジエンなどを架橋させたゴムなどを、合成ゴム(synthetic rubber)という。 ブタジエンも単量体に二重結合を持っている。
合成ゴムには、イソプレンゴムやブタジエンゴムの他にも、クロロプレンゴムやスチレン・ブタジエンゴムやブチルゴムなどがある。
付加重合による合成ゴム
[編集]ブタジエンゴムとクロロプレンゴムは付加重合によりゴム化する。
ブタジエンゴムでは、ブタジエンCH2=CH-CH=CH2から、ブタジエンゴム[-CH2-CH=CH-CH2-]n へとなる。シス型とトランス型があり、弾性に富むのはシス型のほうである。シス型を多く得るにはチーグラー触媒 TiCl4-Al(C2H5)3 を用いる。
摩耗性に優れているので靴底や、スチレンブタジエンゴムと配合させてタイヤなどに用いられる。なお、タイヤの色が黒いのは、補強材として炭素を加えているからである(※ 参考文献: 数研出版の教科書より)。
クロロプレンゴムにもシス型とトランス型が有る。 クロロブレンの単量体(重合前のこと)の示性式は CH2=CCl-CH=CH2 である。
共重合による合成ゴム
[編集]以上のブタジエンゴムは1種類のブタジエンから合成する合成ゴムであった。重合の単位となる分子を単量体というが、このように1種類の単量体しか用いない場合とは違い、複数種の単量体を用いるゴムを共重合ゴム(きょうじゅうごうゴム)という。 たとえばスチレン・ブタジエンゴムはスチレンとブタジエンを単量体とした共重合ゴムである。
また、ゴムにかぎらず、単量体(monomer)が複数ある重合結合を共重合(copolymerlization)という。 共重合で生成した高分子化合物を共重合体(copolymer)という。
- スチレン・ブタジエンゴム
略称はSBR。 ブタジエン (CH2=CH−CH=CH2) とスチレン(C6H5−CH=CH2) が共重合したもの。

耐磨耗性が良いので、タイヤなどに用いられることが多い(※ 参考文献: 実教出版の教科書より)。なお、タイヤの色が黒いのは、補強材として炭素を加えているからである(※ 参考文献: 数研出版の教科書より)。
- アクリロニトリル・ブタジエンゴム
略称はNBR。アクリロニトリル・ブタジエンゴムも共重合ゴムである。 耐油性が高く、このため石油ホースなどにも用いられてる(※ 参考文献: 東京書籍の教科書より)。
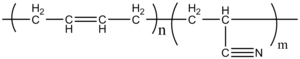
シアノ基(ニトリル基) R-C≡N の極性のため、耐油性が高い(※ 第一学習社の教科書で、この説を採用している。)。なお一般に、油は無極性であるので、極性の高い分子とは油は混じりにくい。
- ※ 参考書: 三省堂『化学I・IIの新研究』(卜部吉庸(うらべよしのぶ) 著)も、このシアノ基の極性による耐油性の説を採用している。
シリコーンゴム
[編集]つぎに述べるシリコーンゴムのように、炭素原子以外が骨格になっているゴムもある。
ジクロロジメチルシランを加水分解すると、ケイ素を含む重合体のポリメチルシロキサンが得られる。 これの架橋に、架橋剤として過酸化ベンゾイルなどの過酸化物の架橋剤を用いて架橋をすると、(-C-C-)といった架橋結合をもったシリコーンゴムが得られる。 シリコーンゴムの架橋には硫黄は用いない。


付加重合による重合とは違い、シリコーンゴムは二重結合を持たないので、大気中の酸素による二重結合の酸化による劣化が少ないので、酸化しづらく耐久性などの性質が優れる。
なお、過酸化ベンゾイルは、非常に酸化能力が強く、危険物であり取り扱いには注意が必要であり、消防法による危険物としての適用を受ける。
