高校化学 酸素を含む脂肪族化合物
アルコール
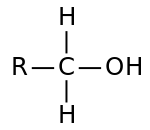
[編集]炭化水素の水素をヒドロキシ基 -OHで置換した構造の化合物をアルコール(alcohol)という。
| 示性式 | 名称 | 構造式 |
|---|---|---|
| CH3OH | メタノール | 
|
| C2H5OH | エタノール | 
|
アルコールは分子中のヒドロキシ基の個数や結合の仕方による、いくつかの分類がある。
アルコール分子中のヒドロキシ基の個数を価数という。分子中のヒドロキシ基が1個のものを1価アルコール、2個のものを2価アルコールなどという。2価以上のものを多価アルコールという。
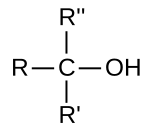
ヒドロキシ基に結合している炭素原子に結合している炭素原子の個数が、1または0個ものを第一級アルコール、2個のものを第二級アルコール、3個のものを第三級アルコールという。
| 分類 | 構造 | 化合物の例 | 沸点 |
|---|---|---|---|
| 第一級 アルコール |
 |
1-ブタノール 2-メチル-1-プロパノール |
117℃ 118℃ |
| 第二級 アルコール |
 |
 2-ブタノール |
99℃ |
| 第三級 アルコール |
 |
 2-メチル-2-プロパノール |
83℃ |
二クロム酸カリウムなどで、第一級アルコールと第二級アルコールを酸化すると、それぞれアルデヒド、ケトンを生じ、アルデヒドをさらに酸化するとカルボン酸になる。第三級アルコールは酸化されにくい。
アルコールの性質
[編集]水溶性
[編集]アルコールは親水性のヒドロキシ基と疎水性の炭化水素基をもつ。そのため、エタノールなどの低級アルコールや、グリセリンのような-OH基の多いアルコールは、水に溶けやすい。炭素数の割合が多くなると炭化水素としての性質が強くなり、水に溶けにくくなる。たとえば、炭素数が4の1-ブタノールや炭素数が5の1-ペンタノールは水に難溶である。
また、アルコールは水に溶けても電離しないため中性である。
融点と沸点
[編集]アルコールのOH基によって、水素結合が形成されるため、分子量が同程度の炭化水素と比べて、沸点や融点が高い。
アルコールの反応
[編集]ナトリウムとの反応
[編集]アルコールに金属ナトリウムNaを加えると、水素が発生し、ナトリウムアルコキシド を生じる。
- (エタノールの場合)
炭素数が多いほどナトリウムと穏やかに反応するようになる。この反応は有機化合物中のヒドロキシ基の有無を調べる一つの方法である。
ナトリウムアルコキシド に水を加えると、加水分解して水酸化ナトリウムを生じるため塩基性を示す。
酸化反応
[編集]- アルコールに適当な酸化剤を用いて酸化させた場合
- 第一級アルコールを酸化させると、まずアルデヒドになり、アルデヒドがさらに酸化すると、カルボン酸になる。
- 第二級アルコールは、酸化されるとケトンになる。
- 第三級アルコールは、酸化されにくい。
脱水反応
[編集]濃硫酸を加熱して約130℃にしたものに、アルコールを加えると、アルコール分子内での脱水反応が起きたり、もしくはアルコールの2分子間で脱水反応が起きて、エーテルやアルケンを生じる。
具体的には、エタノールと濃硫酸とを混合し、約170℃に加熱するとエチレンを生じる。約130℃で加熱すると、分子間脱水が優先してジエチルエーテルを生じる。
なお、このジエチルエーテルの生成のように、2つの分子間から水などの小さな分子がとれて1つの分子になることを、縮合(condensation)という。
メタノール
[編集]メタノール(CH3OH)はメチルアルコールとも呼ばれる、無色透明の液体である。
人体には有毒で、飲むと失明の恐れがある。水と混和する。
メタノールの製法は、触媒に酸化亜鉛 ZnO と を用いて、一酸化炭素 CO と水素 H2 とを反応させる。
メタノールは、溶媒や燃料のほか、薬品の原料や化学製品の原料などとして、用いられている.
二クロム酸カリウム水溶液などによりメタノールは酸化され、ホルムアルデヒドとなる。
- (*)水素原子が分子から奪われる酸化反応である。
エタノール
[編集]エタノール(C2H5OH)は無色透明の液体である。エチルアルコールとも呼ばれる。アルコール飲料(酒)に含まれている。糖やデンプンなどの発酵により、エタノールが得られる。
- 発酵:
工業的にはエチレンに水分子を付加することにより合成される。
- 合成:
濃硫酸には脱水作用があるため、エタノールと濃硫酸とを混合して加熱すると脱水反応がおこる。しかし、温度により異なった脱水反応がおこり、異なる物質が生成する。130℃程度で反応させるとエタノール2分子から水が取り除かれてジエチルエーテルを生じる。
一方、160℃程度で反応させるとエタノール1分子の中で水が取り除かれ、エチレンを生じる。
参考: 多価アルコール
[編集]エチレングリコール
[編集]
エチレングリコール(1,2エタンジオール)は、2価アルコールであり、無色で粘性が高い、不揮発性の液体である。水と混和する。
自動車のラジエーターの不凍液として用いられる。また、合成繊維や合成樹脂の原料としてもエチレングリコールは用いられる。
エチレングリコールには甘味があるが、毒性がある。

エチレンを(ある触媒のもと)酸素と反応させ、エチレンオキシドという物質をつくる。
そして、そのエチレンオキシドを(酸によって)加水分解させ、エチレングリコールをつくれる。
※ 「エチレンオキシド」が高校範囲外である。かなり高度な受験参考書ですら、「エチレンオキシド」については触れられてない場合がほとんどである。なので高校生は、「エチレンオキシド」について大学受験では暗記の必要は無いだろう。
グリセリン
[編集]
1,2,3-プロパントリオール(グリセリン)は、3価アルコールであり、無色で粘性が高い、不揮発性の液体である。水とは任意の割合で溶け合う。無毒であり甘味があるので、化粧品や医薬品の原料などに用いられる。火薬(ニトログリセリン)の原料や合成樹脂の原料ともなる。
動物の体内に存在する油脂は、グリセリンと脂肪酸のエステルである。
エーテル
[編集]酸素原子に2個の炭化水素基が結合した構造 をもつ化合物をエーテル(ether)という。エーテル中での-O-の結合を、エーテル結合という。
| 示性式 | 名称 | 構造式 | 沸点 |
|---|---|---|---|
| CH3-O-CH3 | ジメチルエーテル | 
|
-25℃ |
| C2H5-O-C2H5 | ジエチルエーテル | 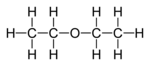
|
34℃ |
| C2H5-O-CH3 | エチルメチルエーテル | 7℃ |
エーテルの性質
[編集]エーテルは1価アルコールと構造異性体の関係にある。たとえばジメチルエーテルとエタノールは互いに異性体である。
エーテルはヒドロキシ基 -OH を持たないため、水に溶けにくく、水素結合をしないため、エーテルの沸点・融点はアルコールよりも低い。 たとえば、沸点はジメチルエーテル CH3-O-CH3 の融点は-145℃であり沸点は -25℃ であり、分子量が同程度のエタノール(沸点78℃)とくらべて、かなり低い。
また、エーテルは、ナトリウムとも反応しない。
アルコールを濃硫酸と混合して脱水縮合させることでエーテルが生成する。
ジエチルエーテル
[編集]ジエチルエーテル(diethyl ether)は無色で揮発性の液体であり、引火しやすいため取り扱いに注意が必要である。麻酔性がある。 ジエチルエーテルは水には溶けにくく、有機物をよく溶かすので、有機溶媒としても用いられる。油脂などの有機化合物を抽出するさいの溶媒として、ジエチルエーテルが用いられる。
エタノールに濃硫酸を加えて130~140°Cで加熱するとジエチルエーテルが生成する。
単にエーテルというと、ジエチルエーテルを指す。
エーテルの合成
[編集]ナトリウムアルコキシド とハロゲン化炭化水素 の縮合によってエーテルが生成する。
カルボニル化合物
[編集]原子団 をカルボニル基(carbonyl group)といい、カルボニル基をもつ化合物のことをカルボニル化合物(carbonyl compound)という。
をカルボニル基(carbonyl group)といい、カルボニル基をもつ化合物のことをカルボニル化合物(carbonyl compound)という。
ホルミル基 -CHO をもつ化合物をアルデヒド(aldehyde)という。 ホルミル基はカルボニル基の一方が水素である構造をしている。

また、カルボニル基に2個の炭化水素基が結合した化合物 R -CO- R’ のことをケトンという。
カルボニル化合物には、アルデヒド、ケトン、カルボン酸などがある。
アルデヒド
[編集]| 示性式 | 名称 | 構造式 |
|---|---|---|
| HCHO | ホルムアルデヒド | 
|
| CH3CHO | アセトアルデヒド | 
|
性質
[編集]アルコールで学んだように、第一級アルコールを酸化するとアルデヒドが得られ、アルデヒドを酸化するとカルボン酸になる。
- 還元性
アルデヒド基には還元性があり、他の物質を還元して自らは酸化されやすい。つまりアルデヒドはカルボン酸になりやすい。
-
- (*) 酸素を受け取る酸化反応が起こる。
そのため、アルデヒドは銀鏡反応やフェーリング反応といった還元性の有無を調べる反応により検出することができる。
- 水溶性
分子量の小さいアルデヒドやケトンは、水に溶けやすい。
銀鏡反応
[編集]
アンモニア性硝酸銀水溶液にアルデヒドをくわえて加熱すると、銀イオン Ag+ が還元されて、銀 Ag が析出する。これを
銀鏡反応は、以下のような反応である。 このアンモニア性硝酸銀水溶液にアルデヒドなどの還元性のある物質を加え、湯浴で加熱すると、ジアンミン銀(I)イオンが還元されて単体の銀が析出し、試験管の壁に付着する。アルデヒド自身は酸化されてカルボン酸となる。
フェーリング反応
[編集]
フェーリング液(Fehling′s solution)と呼ばれる液体にアルデヒドを加えて加熱すると、フェーリング液中の銅(II)イオンCu2+が還元されて、酸化銅(I) Cu2Oの赤色沈殿が生成することから、アルデヒドが還元性をもつことを確認することができる。この反応をフェーリング反応という。なお、アルデヒド自身はこのフェーリング反応で酸化されてカルボン酸となる。
- 参考
- フェーリング液とは、硫酸銅(Ⅱ)、酒石酸ナトリウムカリウムと、水酸化ナトリウムの混合水溶液である。硫酸銅(Ⅱ)水溶液をA液、酒石酸ナトリウムカリウムと水酸化ナトリウムの混合水溶液をB液として、A液とB液とを使用直前に混合して調整する。これは、フェーリング液が不安定で、長期間保存することができないためである。A液は硫酸銅(Ⅱ)水溶液なので青色をしているが、これにB液を加え混合したフェーリング液は、銅(Ⅱ)の錯イオンを生じて深青色の水溶液となる。
ホルムアルデヒド
[編集]
ホルムアルデヒド(HCHO)はもっとも単純な構造のアルデヒドであり、水に溶けやすい無色刺激臭の気体である。ホルマリン(formalin)はホルムアルデヒドの約37%水溶液であり、動物標本の保存溶液や、消毒剤として用いられる。
(※ 分子量の小さいアルデヒドは一般に、水溶性である事を思い出そう。そもそもカルボニル基が水溶性。)
ホルムアルデヒドはメタノールを酸化することで得られる。銅線を加熱して酸化銅(Ⅱ)とし、これを試験管に入れたメタノールに近づけると、メタノールが酸化されてホルムアルデヒドを生じる。
なお、銅線を加熱して酸化銅にする方程式は
なので、これとまとめて、反応式を
と書く場合もある。
なお、ホルムアルデヒドがさらに酸化されると、ギ酸になる。ギ酸も条件によってはさらに酸化されて二酸化炭素と水を生じる。
アセトアルデヒド
[編集]
アセトアルデヒド(CH3CHO)は分子中に炭素が2つあるアルデヒドであり、水や有機溶媒によく溶ける。
(※ 分子量の小さいアルデヒドは一般に、水溶性である事を思い出そう。そもそもカルボニル基が水溶性。)
実験室ではアセトアルデヒドは、エタノールを酸化することで得られる。エタノールに酸化剤として硫酸酸性の二クロム酸カリウムK2Cr2O7 水溶液を加え加熱すると、アセトアルデヒドが生じる。
また、工業的にはアセトアルデヒドの製法は、塩化パラジウム PdCl2 と塩化銅 CuCl2 を触媒に用いて、酸素によってエチレンを酸化することでも得られる。
アセトアルデヒドは、酢酸の原料や防腐剤として用いられる。
アセトアルデヒドがさらに酸化されると、酢酸になる。
飲酒とアセトアルデヒド
[編集](※ 高校化学の範囲内。第一学習社の検定教科書に記述あり。)
日本酒や洋酒など、市販のアルコール飲料は、エタノールの水溶液である。
ヒトが酒(エタノール水溶液)を飲むと、おもに腸でエタノールが吸収され、血管を通って肝臓に運ばれ、そして肝臓で酵素によってアセトアルデヒド CH3CHO に分解される。さらに別の酵素によって、酢酸 CH3COOH に変化する。そして最終的に、二酸化炭素と水に分解される。
※ 範囲外: カルボニル基の極性
[編集](※ 範囲外:) 検定教科書には書かれてないが、カルボニル基には極性があり、Cがδ+の電荷を帯びており、Oがδーの電荷をおびている。
二重結合を介して、
- Cδ+ = Oδー
のように分極している。
また、カルボニル基をもつ簡単な分子は水に溶けやすい理由として、おそらく、カルボニル基の酸素原子が、溶液の水素分子と水素結合をするためであろう、と考えられている。(※ 参考文献: サイエンス社『工学のための有機化学 新訂版』、新井貞夫、185ページ) つまり、C=Oは親水基であろうと考えられている。(※ 参考文献: 『チャート式シリーズ 新化学I』平成19年第5刷)

ケトン
[編集]ケトン基(-CO-)を分子中に含む物質を一般にケトンと呼ぶ。右には主なケトンを示す。
| 示性式 | 名称 | 構造式 |
|---|---|---|
| CH3COCH3 | アセトン | 
|
一般的な性質
[編集]第二級アルコールを酸化するとケトンが得られる。逆に、ケトンを還元すると、第二級アルコールになる。
ケトンはアルデヒドと同様にC=Oの二重結合を持つ。このアルデヒド基・ケトン基のC=Oの二重結合をまとめてカルボニル基と呼ぶことがあるが、ケトンはアルデヒドと異なり、ケトンは還元性を持たない。そのため、ケトンは、銀鏡反応やフェーリング反応を起こさない。
また、アルデヒドはさらに酸化されてカルボン酸となるが、ケトンは酸化されにくい。
アセトン
[編集]アセトン(CH3COCH3)はもっとも単純な構造のケトンである。アセトンは無色の芳香のある液体(沸点56 ℃)であり、アセトンは水に混ざりやすい。また、アセトンは、有機溶媒としても用いられる場合がある。
実験室でのアセトンの製法は、第二級アルコールである2-プロパノール(CH3CH(OH)CH3)を酸化することで得られる。2-プロパノールに酸化剤の硫酸酸性二クロム酸カリウム水溶液を加え加熱すると、アセトンを生じる。
また、アセトンは酢酸カルシウムの乾留によっても、実験室でアセトンを得ることができる。酢酸カルシウムの固体を試験管に入れ、加熱すると、アセトンを生じる。
工業的には、クメン法によって作られる。
ヨードホルム反応
[編集]水酸化ナトリウム水溶液のような塩基性溶液中、アセトンにヨウ素を反応させると、特有の臭気をもつヨードホルム CHI3 の黄色沈殿が生成する。この反応をヨードホルム反応(iodoform reaction)という。
このヨードホルム反応は、アセチル基 CH3CO- を持つケトンやアルデヒド、または部分構造 CH3CH(OH)-(1-ヒドロキシエチル基)を持つアルコールが起こす。
酢酸はCH3CO-構造を含むが、酢酸はカルボン酸であり、ケトンやアルデヒドではないのでヨードホルム反応は起こさない。酢酸エチルも、ヨードホルム反応を起こさない。
ヨードホルム反応の起きる代表的な化合物は、アセトン、アセトアルデヒド、エタノール、2-プロパノールなどである。
カルボン酸
[編集]カルボキシ基 -COOH を含む化合物をカルボン酸という。
| 示性式 | 名称 | 構造式 |
|---|---|---|
| HCOOH | ギ酸 | 
|
| CH3COOH | 酢酸 | 
|
カルボン酸の性質
[編集]アルデヒドの部分で学んだように、アルデヒドを酸化するとカルボン酸が得られる。
カルボン酸の酸性の原因は、COOHの部分の水素Hが水溶液中で電離するからである。
| 分類 | 名称 | 示性式 | 融点 | その他 |
|---|---|---|---|---|
| 飽和モノカルボン酸 | ギ酸 | HCOOH | 8.40℃ | アリから発見 |
| 酢酸 | CH3COOH | 16.7 ℃ | 食酢の成分 | |
| プロピオン酸 | CH3CH2COOH | -20.8℃ | 乳製品に含まれる | |
| パルミチン酸 | C15H31-COOH | 63°C | ||
| ステアリン酸 | C17H35-COOH | 71°C | ||
| 不飽和モノカルボン酸 | アクリル酸 | CH2=CHCOOH | 14℃ | 塗料、接着剤など |
| メタクリル酸 | CH2=CHCOOCH3 | 16℃ | -- | |
| オレイン酸 | C17H33-COOH | 13°C | 二重結合1個 | |
| リノール酸 | C17H31-COOH | -5°C | 二重結合2個 | |
| リノレン酸 | C17H29-COOH | -11°C | 二重結合3個 | |
| 飽和ジカルボン酸 | シュウ酸 | HOOC-COOH | 187℃(分解) | ホウレン草などに存在 |
| アジピン酸 | HOOC–(CH2)4–COOH | 153℃ | ナイロンの原料 | |
| 不飽和ジカルボン酸 | フマル酸 | C2H2(COOH)2 | 300℃(封管中) | 植物に含まれる |
| マレイン酸 | C2H2(COOH)2 | 133℃ | 合成樹脂の原料 | |
| ヒドロキシ酸 | 乳酸 | CH3CH(OH)COOH | 17℃ | ヨーグルトの成分 |
| 酒石酸 | (CH(OH)COOH)2 | 170℃ | ブドウの果実中に存在 | |
| リンゴ酸 | HOOC-CH(OH)-CH2-COOH | 100°C | 果実中に存在 |
脂肪族の1価カルボン酸を脂肪酸という。
分子中の炭素数が少ない脂肪酸を低級脂肪酸、炭素の多い脂肪酸を高級脂肪酸という。また、炭素間結合が単結合のみの脂肪酸を飽和脂肪酸、二重結合または三重結合を含む脂肪酸を不飽和脂肪酸という[1]。
分子中にカルボキシ基を1つ持つカルボン酸を1価カルボン酸(モノカルボン酸: mono-carboxylic acid)といい、カルボキシ基を2つ持つカルボン酸を2価カルボン酸(ジカルボン酸: di-carboxylic acid)という。
ギ酸
[編集]
ギ酸(蟻酸) HCOOH は常温常圧では刺激臭のある無色の液体で、水溶液は酸性を示す。ギ酸は人体に有害で皮膚や粘膜を侵す。
ギ酸はホルミル基を持つため、還元性があり、酸化剤と反応させるとギ酸自身は酸化されて二酸化炭素となる。

ギ酸は濃硫酸を加えて加熱すると一酸化炭素を生じる。
酢酸
[編集]
酢酸(醋酸) CH3COOH は常温常圧では刺激臭のある無色の液体で、水溶液は酸性を示す。
亜鉛などの金属と反応して水素を発生する。
また、酢酸は弱酸だが炭酸よりは強い酸であるため、炭酸塩と反応して二酸化炭素を生じる。
また、酢酸は融点が17 ℃であり、純度の高い酢酸は冬場になると氷結してしまう。そのような酢酸を氷酢酸と呼ぶ。
酢酸は次のように2分子が水素結合で結合した二量体として存在する。
このため、酢酸の気体から分子量を測定する実験をすると、実験方法によっては、酢酸の分子量の約60の2倍の値である分子量120ほどの実験値が得られる場合もある。
これはその他のカルボン酸にも見られる。

カルボン酸が同程度の分子量のアルコールやアルカンよりも沸点や融点が高いのは、カルボン酸がこのように二量体を形成するからである。
マレイン酸とフマル酸
[編集]マレイン酸とフマル酸(COOHCH=CHCOOH)はどちらも不飽和ジカルボン酸であり、シス-トランス異性体の関係にある。
| マレイン酸(シス形) | フマル酸(トランス形) |
|---|---|

|

|
マレイン酸とフマル酸の化学的性質は大きく異なる。
マレイン酸は160℃で加熱すると脱水反応を起こし無水マレイン酸になる。これは、2つのカルボキシ基の位置関係の違いによるものである。カルボキシ基の位置が遠いトランス形のフマル酸ではこの反応は起こらない。

その他のカルボン酸
[編集]カルボン酸は果物に多く含まれている。たとえばブドウに含まれる酒石酸や、柑橘類に含まれるクエン酸、リンゴに含まれるリンゴ酸はいずれもカルボン酸である。
分子中にCOOH基とOH基をもつカルボン酸をヒドロキシ酸(Hydroxy acid)という。
乳酸は、糖類の発酵によって生じる。
鏡像異性体
[編集]
乳酸(lactic acid)は、ヨーグルトなどの乳製品に含まれているヒドロキシ酸である。乳酸は炭素原子に結合している4つの原子や原子団が、4つとも異なる。このように、4本のうでにそれぞれ異なる置換基が結合した炭素原子を、不斉炭素原子(asymmetric carbon atom)という。たとえば、乳酸(CH3CH(OH)COOH)には不斉炭素原子が1個存在する。

上図を見ると分かるように、*印をつけた炭素原子の周りに、それぞれ色分けされた4つの異なる置換基が結合しているのが分かる。この*印がついた炭素原子が不斉炭素原子である。
ここで上の構造式は平面上に書かれているが、現実にはこの分子は立体として存在する。不斉炭素原子を中心とした正四面体の各頂点に、結合軸が配置しているのである。すると、構造式が上のように同一であっても、立体的にはどう動かしても重ね合わせることのできないものが存在する。これらは、たがいに鏡に写した関係にある。
このように、鏡写しの関係になった異性体を鏡像異性体(enantiomer)[2]という。
鏡像異性体の一方をL体といい、もう一方をD体という。
鏡像異性体のたとえとして、右手と左手との関係にたとえられる。
鏡像異性体は、融点や密度などの物理的性質や、化学反応に対する化学的性質はほとんど同じである。しかし、旋光性や、味、匂いなどの生理作用が異なる。
水溶液中の水素結合
[編集]カルボン酸が比較的に水に溶けやすいものが多いのは、水素結合によると考えられている。
また、カルボン酸と同程度の分子量のアルコールよりも、カルボン酸は水溶性が高い。(※ 参考文献: 新井貞夫、『工学のための有機化学』、サイエンス社、2014年新版、P212)
とはいえ、酢酸こそ水に溶けやすいものの、無水酢酸は水に溶けにくい。
エステル
[編集]-COO- で表される構造をエステル結合(ester bond)という。エステル結合をもつ化合物をエステル(ester)といい、エステルを生成する脱水反応をエステル化(esterification)という。
カルボン酸とアルコールを酸触媒で加熱するとエステルが生成する。

比較的小さな分子量のエステルは果物に似た香りを持つため、香料に使用されるものもある。また、自然界にも、果実の香り成分として、小さな分子量のエステルが存在している。
エステルは水には溶けにくく、有機溶媒に溶ける。
エステルは加水分解してカルボン酸とアルコールが生成する。

エステル化反応は可逆反応であり、エステル化と同時に加水分解も起こっている。そのため、エステルを多く生成するためにしばしば脱水剤や触媒として濃硫酸が用いられる。
けん化
[編集]エステルは、水酸化ナトリウムのような強塩基の水溶液をくわえて加熱すると、カルボン酸の塩とアルコールに加水分解される。このような、強塩基によるエステルの分解反応をけん化(saponification)という。
酢酸エチル
[編集]酢酸とエタノールの混合物に触媒として濃硫酸をくわえて加熱すると、酢酸エチル(ethyl acetate)CH3-COO-C2H5 が得られる。
酢酸エチルは、果実のような香りをもつため、香料として用いられる。 酢酸エチルは、沸点77℃であり、揮発性の液体であり、水より軽い。
カルボン酸以外のエステル
[編集]カルボン酸とアルコールの反応だけではなく、オキソ酸とアルコールとの間の脱水反応もエステル化と呼ぶ。例えば、アルコールであるグリセリンと、オキソ酸である硝酸が脱水・エステル化すると、ニトログリセリンを生じる。ニトログリセリンは爆発性のある物質で、ダイナマイトなどに用いられる。
油脂
[編集]

脂肪酸とグリセリン がエステル結合した化合物を油脂という。
油脂のうち、常温で固体の油脂を脂肪(fat)、液体の油脂を脂肪油(fatty oil)という。
脂肪は飽和脂肪酸により構成されているものが多く、脂肪油は不飽和脂肪酸により構成されているものが多い。
これは、飽和脂肪酸は直線状であるのに対して、不飽和脂肪酸は二重結合の部分で折れ曲がった形をしているため、この立体構造により分子同士が近づきにくくなり、分子間力が働きにくくなるため、不飽和脂肪酸の融点が低くなることによる。
天然の油脂を構成する脂肪酸には炭素数が16か18のものが多い。
以下に、油脂を構成する主な脂肪酸の例を示す。
| 飽和脂肪酸 | 不飽和脂肪酸 | ||
|---|---|---|---|
| 名称 | ステアリン酸 | オレイン酸 | リノール酸 |
| 示性式 | C17H35COOH | C17H33COOH | C17H31COOH |
| 分子模型 |  |

| |

不飽和脂肪酸の炭素間二重結合では、アルケンと同様に付加反応が起こる。油脂を構成する不飽和脂肪酸に、ニッケル Ni を触媒として用いて水素を付加させると、融点が高くなるため、常温で固体の油脂へと変化する。このようにして脂肪油から生じた固体の油脂を硬化油(hardened oil)という。植物油をもととする硬化油はマーガリンなどに用いられる。硬化により飽和脂肪酸とすることには、長期間の保存の間に空気中の酸素が不飽和結合に付加して酸化されることを防ぐ役割もある。
油脂のけん化
[編集]油脂に水酸化ナトリウムを加えて加熱すると、油脂はけん化(鹸化)されて、高級脂肪酸のナトリウム塩(セッケン(石鹸))とグリセリンになる。 洗い物などでもちいる石鹸とは、このような高級脂肪酸のナトリウム塩である。
さて、油脂1分子に、エステル結合が3つある。よって油脂1molのけん化には、水酸化ナトリウム3molが必要になる。
セッケンは弱酸と強塩基の塩であるが、水中ではセッケンは一部が加水分解し、弱塩基性を示す。
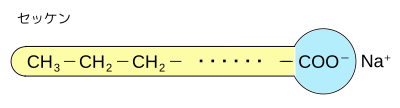
セッケンの炭化水素基部分(図中 R- の部分)は疎水性である。セッケンのカルボキシル基COONaの部分は親水性である。

水中では、多数のセッケンの疎水基の部分どうしが集まり、親水基を外側にして集まる構造のコロイド粒子のミセル(micelle)になる。
セッケン分子のように、分子中に親水基と疎水基を合わせ持つ物質を界面活性剤という。
セッケン水に油を加えると、セッケンの疎水部分が油を向いて、多数のセッケン分子が油を取り囲むので、油の小滴が水中に分散する。このような現象を乳化(にゅうか、emulsification)という。そして、セッケンのように、乳化をおこさせる物質を乳化剤という。
セッケンの洗浄作用の理由は、主に、この乳化作用によって、油を落とすことによる。
セッケンは水の表面張力を低下させる。
セッケン
[編集]油脂に水酸化ナトリウム水溶液を加え加熱するとけん化(鹸化、正字:鹼化)して、高級脂肪酸のナトリウム塩とグリセリンを生じる。この高級脂肪酸の塩をセッケン(石鹸、正字:石鹼)という。脂肪酸は弱酸であり、水酸化ナトリウムは強塩基であるから、これらの塩であるセッケンの水溶液は弱塩基性を示す。
セッケン分子は、疎水性の炭化水素基と、親水性のイオン基からなる。このように、親水基と疎水基を両方持つ物質を界面活性剤あるいは乳化剤という。

このセッケン分子は疎水部を内側に、親水部を外側に向けて寄り集まった状態で集まって粒子(ミセル)を形成し、水に溶けている。水溶液中に油が存在すると、セッケン分子が油の周囲を取り囲み、疎水部は油となじみ、親水部は外側へ向いて、微粒子を形成し水溶液中へ分散し、水溶液は白濁する。この現象を乳化という。

この乳化作用により、油汚れを洗浄することができる。
マヨネーズの油と水をくっつける、卵黄のレシチンも乳化剤である。
なお、一般に、水と油の界面に配列する物質が、食べられない物質の場合に界面活性剤という場合が多い。いっぽう、食品などからつくった場合などで、食べられる場合には乳化剤という場合が多い。明確には決まっていない(検定教科書でも、とくに決められてはいない)。
セッケンがカルシウムイオンCa+やマグネシウムイオンMg+などの溶けた硬水と混じると、水に溶けにくい塩 (R-COO)2Ca などが生じるので、セッケンの泡立ちが悪くなる。
界面活性剤の分類
[編集]陽イオン界面活性剤には、洗浄力は無く、柔軟剤などとして使われる。陽イオン界面活性剤による洗剤は、逆性セッケンとも言われる。
セッケンは、陰イオン性界面活性剤である。
両性界面活性剤は、酸性溶液中では陽イオンになり、塩基性溶液中では陰イオンになる。
合成洗剤
[編集]しかし、セッケン分子は や と反応して水に溶けにくい塩を生じる。そのため、イオンを多く含む硬水や海水中では洗浄力が落ちる。
このようなセッケンの短所を改良したアルキルベンゼンスルホン酸ナトリウム R-C6H4-SO3-Na+(略称:ABS)やアルキル酸ナトリウム R-SO3-Na+ (略称:AS)は、高級アルコールや石油などから人工的に合成される。
これらアルキルベンゼンスルホン酸ナトリウムやアルキル酸ナトリウムを合成洗剤(synthetic detergent)という。
- ASの製法
ASの製法は、高級アルコールの1-ドデカノール C12H25-OH に濃硫酸 H2SO4 を作用させるとエステル化されることで硫酸水素ドデシル C12H25-SO3H ができ、この硫酸水素ドデシルを水酸化ナトリウムで中和することで硫酸ドデシルナトリウム C12H25-SO3Na が得られる。
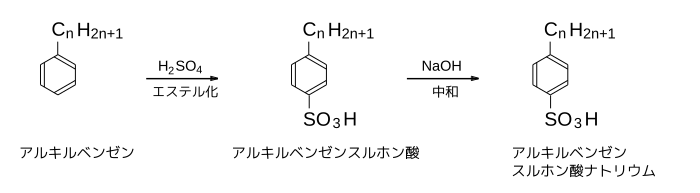
- ABSの製法
炭化水素基が結合したベンゼン(アルキルベンゼン)を濃硫酸とスルホン化すると、アルキルベンゼンスルホン酸が得られる。このアルキルベンゼンスルホン酸を水酸化ナトリウムで中和することでアルキルベンゼンスルホン酸ナトリウムが得られる。
合成洗剤の性質
[編集]セッケン水溶液は弱塩基性である。いっぽう、合成洗剤は強酸と強塩基の塩であるため、加水分解せず、よってアルキルベンゼンスルホン酸ナトリウムなどの水溶液は中性である。また、合成洗剤は、硬水中でも持ち手も、不溶性の沈殿を作りにくい。
合成洗剤の分子は、疎水部と親水部からなり、乳化作用により油汚れを洗浄することができる。
洗濯用洗剤のビルダー
[編集]合成洗剤には、その洗剤としての働きを助けるため、界面活性剤以外にも、さまざまな成分が入っている。
ひとくちの合成洗剤といっても、台所用洗剤や洗濯用洗剤など、いろいろとあり、その種類によって、組成などの違う。
洗濯用洗剤では、合成洗剤の添加剤をビルダー(builder)という。
たとえば、洗浄力を落とすカルシウムイオンやマグネシウムイオンを取り除くため(合成洗剤はセッケンとは違い、これらのイオンがある硬水でも洗浄力を持つが、それでも、これらのイオンが無い軟水のほうが良い洗浄効果をもつ)、ゼオライト(アルミノケイ酸ナトリウム)などが入ってる。
なお、かつてリン酸塩がこれらのイオンを除くための添加剤として用いられていたが、排水が河川などの富栄養化をまねき水質汚染の原因となるため、現在はあまり用いられてない。日本では、1980年ごろから、合成洗剤での水の軟水化のための添加剤がリン酸塩からゼオライトに切り換えられた。
そのほか、タンパク質汚れを落とすための分解酵素プロテアーぜや、油汚れを落とすための脂肪分解酵素リパーぜなど、酵素が添加されていたりする。
また、一般にアルカリ性のほうが汚れが落ちやすいので、炭酸ナトリウムが添加剤として加えられる。なお、台所洗剤やシャンプーでは、アルカリが身体を痛めるため、このようなアルカリ性の物質は加えられない。























![{\displaystyle {\ce {RCHO + 2[Ag(NH3)2]+ + 3OH- -> RCOOH + 4NH3 + H2O + 2Ag v}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7bbdeb7a4ea6c2702589d6e3d19becb124f39625)