高等学校化学/有機化合物の特徴
有機化合物
[編集]炭素を含む化合物を有機化合物(organic compound)という。しかし、炭素の酸化物及びシアン化物、炭酸塩は例外的に有機化合物ではなく無機物質として扱われる。デンプンや糖類、エタノール、酢酸、脂肪などは有機化合物である。
もともとは生物に関係する物質を有機物、鉱物から得られる物質を無機物質と分類していた。
かつて有機化合物は生物だけが作れると考えられていた時代もあったが、1828年にドイツのウェーラーが、無機物質のシアン酸アンモニウム NOH4CN から尿素 CO(NH2)2 を合成したことにより、無機物質から人工的に有機物質が合成できる事が分かった。
特徴
[編集]有機化合物は無機化合物とは、大きく異なる特徴をもつ。
- 有機化合物を構成する主な元素は、 C, H, O, N であり、元素の種類は限られるが、炭素の原子価は 4 で、さまざまな構造を取れるため、多くの種類の有機化合物が存在する。
- 有機化合物は極性が少ないものが多いため、水に溶けにくいものが多い。エタノールやジエチルエーテルなどの有機溶媒によく溶けるものが多い。また、水に溶ける有機化合物でも電離するものは少ない。
- 有機化合物の融点や沸点は比較的に低く、化合物によっては加熱により分解して炭素と水になるものもある。
- 空気中で燃焼すると、水と二酸化炭素などを発生する。
分類
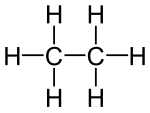
[編集]炭素 C と水素 H のみからなる化合物を炭化水素(hydrocarbon)という。炭化水素の構造が、さまざまな有機化合物の構造では、基本的な構造になる。
有機化合物の分子は、炭素原子のつながった構造を骨格として持つ。この炭素原子の結合のしかたにより、有機化合物は2種類に分かれる。
- 飽和化合物(saturated compound)
- 炭素原子間の結合が全て単結合だけであるもの(例: エタンC2H6、プロパンC3H8)
- 不飽和化合物(unsaturated compound)
- 炭素原子間に二重結合や三重結合を一つ以上持つもの(例: エチレンC2H4)[1]
さらに、炭素原子の骨格の形によっても2種類の分類がある。
- 鎖式(acyclic)
- 炭素原子が直線状、または枝分かれ状に結合しているもの。(例: メタン CH4 、 アセチレン C2H2)
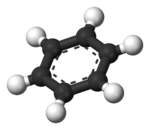
- 環式(cyclic) 炭素原子が環状に結合しているものを含むもの(例: ベンゼンC6H6 、 シクロヘキサンC6H12)
したがって、有機化合物は大まかに、鎖式飽和化合物、鎖式不飽和化合物、環式飽和化合物、環式不飽和化合物の4つに分類することができる。
さらに環式化合物はベンゼンを含むものを芳香族化合物と分類する。
芳香族化合物でない有機化合物を脂肪族化合物という。
脂肪族炭化水素のうち、特に、鎖式で飽和の炭化水素をアルカン(alkane)と言い、環式で飽和の炭化水素をシクロアルカン(cycloalkane)という。また、炭素原子間の二重結合を1つもつ鎖式不飽和炭化水素をアルケン(alkene)と言い、三重結合を1つ持つ鎖式不飽和炭化水素をアルキン(alkyne)という。
不飽和度
[編集]不飽和度(Degree of unsaturation)または水素不足指数(Index of hydrogen deficiency、IHD)は、ある有機化合物の水素原子がどの程度不足しているかを表す指標である。
具体的には、以下のように表される。
| 不飽和度・水素不足指数 |
|
有機化合物中の炭素原子の数をC、水素原子の数をH、窒素原子の数をN、ハロゲン原子の数をXとすると、不飽和度(水素不足指数)Uは と求まる。 |
不飽和度を見れば、有機化合物の構造がある程度絞られる。
- U=0のときは全て単結合である。
- U=1のときは二重結合または環構造を一つ含む。
- U=2のときは二重結合・環構造を一つづつまたはいずれかを二つまたは三重結合を一つ含む。
- U=4のときはベンゼン環を含むことが多い。
上以外の値のときは、上の組合せと考える。
骨格式
[編集]z骨格式とは、炭素を線分で表し、炭素に結合する水素を省略した記法である。この記法は有機化合物の構造が見えやすくなり、構造式を書くときの煩雑さが少なくなるという利点がある。骨格式は高等学校では一般に教えられないし、大学入試でも構造式を記述する際は炭素と水素を省略しない記法で記述することを求められる。しかし、ウィキメディア・コモンズには骨格式で書いた構造式が多いからこれを用いることもある。
太字で書いた結合は画面(紙面)の表に、点線で書いた結合は画面(紙面)の裏に飛び出るものとする。こうすることで、化合物の三次元構造を二次元で表現できる。

官能基
[編集]ある原子の構造を持つ化合物は特徴的な性質を示すことがある。この原子の集まりを官能基という。官能基によって化合物の性質を推測することができる。
以下では重要な官能基を紹介する。
| 官能基の名前 | 官能基の構造式 | 化学式 | 化合物の名前 | 例 |
|---|---|---|---|---|
| ヒドロキシ基 | ROH | アルコール
フェノール類[2] |
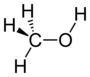 メタノール | |
| カルボキシ基 | 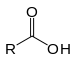 |
RCOOH | カルボン酸 |  酢酸 |
| カルボニル基 | 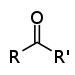
|
RCOR' | ケトン |  ブタノン |
| ホルミル基[3] | 
|
RCHO | アルデヒド |  アセトアルデヒド エタナール |
| ニトロ基 | 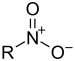
|
RNO2 | ニトロ化合物 | 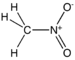 ニトロメタン |
| スルホ基 | 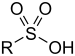
|
RSO3H | スルホン酸 | 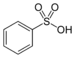 ベンゼンスルホン酸 |
| アミノ基 | RNH2 | アミン | 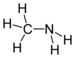 メチルアミン | |
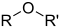
| エーテル結合 | ROR' | エーテル | ジエチルエーテル | |
| エステル結合 | RCOOR' | エステル | 酪酸エチルエステル |
有機化合物の命名
[編集]IUPAC命名法では炭素の数を次の数詞で表すのでまずはこれを覚えてほしい。pent 以降はギリシャ語の数詞から取られている。
| 炭素数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|---|---|---|---|---|
| 語 | Meth | Eth | Prop | But | Pent | Hex | Hept | Oct | Non | Dec |
直線状のアルカンは上の接頭辞のあとに接尾辞 "ane" をつけることで命名する。
例
- methane (メタン)
- ethane (エタン)
- propane (プロパン)
- butane (ブタン)
- pentane (ペンタン)
枝分かれのある場合は、まず一番長い炭素鎖を選ぶ。そして側鎖をアルキル基とみて結合している炭素を番号で表す。
アルケンは上の接頭辞のあとに接尾辞 "ene" をつけ、二重結合している炭素を番号で表すことで命名する。
例
but-2-ene (2-ブテン)
アルキンは上の接頭辞のあとに接尾辞 "yne" をつけ、三重結合している炭素を番号で表すことで命名する。
例
prop-1-yne (1-プロピン)
元素分析
[編集]有機化合物の構造を直接調べることは容易ではないが、その組成式を実験により推定することは比較的簡単である。組成と分子量が分かれば分子式を求めることができ、そこから化合物の構造を絞り込むことができる。
はじめに、ある化合物に含まれている元素の種類を推定する方法を紹介する。基本的に有機化合物は炭素と水素を主成分としてできているが、わずかに塩素原子や窒素原子などを含んでいるものもある。ある化合物にこのような特定の元素が含まれているかを実験で調べることができる。
検出方法
[編集]| 成分元素 | 操作 | 生成物 | 検出方法の例 |
|---|---|---|---|
| 炭素 | 方法1: 酸素中で、酸化銅などの
酸化剤とともに熱して、酸化させる。 方法2: 完全燃焼させる。 |
二酸化炭素
CO2 |
石灰水に通すと白濁する。 |
| 水素 | 水
H2O |
硫酸銅(II)無水物を青変させる。 | |
| 窒素 | 水酸化ナトリウムをまぜて加熱 | アンモニア
NH3 |
ガラス棒の先端に濃塩酸をつけて、
近づけると、白煙を生じる。 |
| 硫黄 | 試料に水酸化ナトリウムを
まぜて加熱したあと、水に溶かす。 |
硫化ナトリウム
Na2S |
生成物の水溶液を、まず酢酸で酸性にして、
さらに酢酸鉛(II)水溶液をくわえると、 硫化鉛(II)の黒色沈殿ができる。 |
| 塩素 | 熱した銅線に触れさせる。 | 塩化銅(II)
CuCl2 |
その銅線を炎の中に入れて、
銅の炎色反応(青緑色)が見られる。 |
- 水素・炭素の検出
- 試料を完全燃焼させると、炭素 C は二酸化炭素 CO2 になり、水素 H は水 H2O になる。燃焼により発生する気体を石灰水に通して白濁すれば、二酸化炭素が生じている。また、燃焼により発生する液体を塩化コバルト紙につけたとき、青色から淡赤色に変化すれば、水が生じている。
- 窒素の検出
- 試料に水酸化ナトリウム NaOH を加え加熱すると、窒素はアンモニア NH3 となる。ガラス棒の先端に濃塩酸をつけてアンモニアに近づけるなどして、もし濃塩酸を近づけて塩酸が白煙をあげれば、窒素を生じている。この白煙は、塩化アンモニウムである。
- 塩素の検出
- 加熱した銅線の先に試料をつけ炎に入れる。すると、塩素は銅と反応して塩化銅(Ⅱ)のCuCl2となり、Cu2+による青緑色の炎色反応が見られる。
- 硫黄の検出
- まず、試料に水酸化ナトリウムを加え加熱したあと、水に溶かす。この溶液をまず酢酸で酸性にして、さらに酢酸鉛(II)水溶液をくわえたとき、もし硫黄が含まれていれば、硫化鉛(I)の黒色沈殿ができる。まず試料に水酸化ナトリウムを加え加熱すると、硫黄は硫化ナトリウムNa2Sとなる。これは水溶液中で電離してS2-となっており、加熱後の液体に酢酸鉛(Ⅱ)水溶液を加えて黒色の沈殿が生じれば、硫化鉛(Ⅱ)が生じている。
もしこの化合物が炭素と水素のみ、あるいはこれらと酸素の3種類で構成されていることが分かっていれば、次の実験により化合物の組成式を推定することができる。
実験方法
- あらかじめ、2つの吸収管(塩化カルシウム菅・ソーダ石灰菅)の質量を測定しておく。
- 酸素ボンベ→燃焼菅→塩化カルシウム菅→ソーダ石灰菅→排気菅の順に接続する。※
- 試料を燃焼管の白金皿に載せ、酸素ボンベから乾いた酸素を吹き込みながらガスバーナーで加熱し燃焼させる。この際、酸化銅(Ⅱ)触媒も加熱する。これにより、不完全燃焼により生じたCOを酸化して完全にCO2とすることができる。
- 試料は燃焼により二酸化炭素と水を発生する。水と二酸化炭素がそれぞれ2つの吸収管に吸収される。
- 燃焼が終了したら、2つの吸収管の質量を測定する。先に求めた質量との差が、吸収した二酸化炭素や水の質量である。
※ソーダ石灰は水・二酸化炭素の両方を吸収するため、塩化カルシウム管よりも先に接続すると水の質量を正しく測定できなくなる。
計算
炭素、水素、酸素の化合物である質量 w の試料の燃焼により水(質量 a)と二酸化炭素(質量 b)が生じたとする。このとき、発生した水の水素原子と二酸化炭素の炭素原子は、ともに試料に由来するものである。したがって、水に含まれる水素原子の質量と、二酸化炭素に含まれる炭素原子の質量は、試料に含まれていた水素原子と炭素原子の質量に等しい。原子量をH=1.0、C=12、O=16とすると、分子量がH2O=18、CO2=44であるから、
- 水素原子の質量wH :
- 炭素原子の質量wC :
となる。すると、試料の残りは酸素原子でできているので、
- 酸素原子の質量wO :
となる。なお、水分子と二酸化炭素分子に含まれている酸素原子はすべて試料由来ではなく、吹き込んだ酸素が結合している分も含まれているので、水と二酸化炭素の質量から求めることはできない。
以上より、試料中の水素、炭素、酸素の質量を求めることができたため、元素の個数の比を求めることができる。元素1個あたりの質量の比は、原子量の比と等しく
- C:H:O = 12:1.0:16
であるから、試料に含まれている各原子の個数の比は、
- C:H:O =
で求められる。組成式は化合物中の原子の個数の比を表すものであるから、この比により組成式が求められる。
ある分子の分子式は、その分子の組成式を自然数倍したものであるから、分子量が求められれば、組成式の式量から現実の原子の個数を計算し、分子式を求めることができる。
なお、元素分析において組成式を実験式と呼ぶ場合がある。
異性体
[編集]分子式が同じでも、構造が異なる化合物を異性体という。特に、構造式が異なるものを構造異性体という。異性体には構造異性体の他にも原子の立体的な配置が異なる立体異性体も存在する。
分子式 で表される有機化合物には次の2つがある。
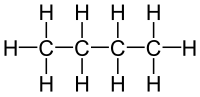
|
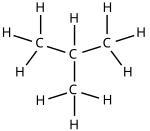
|
| ブタン | 2-メチルプロパン |
このとき、ブタンと2-メチルプロパンは構造異性体の関係にあるという。