高校化学 芳香族化合物
ベンゼン
[編集]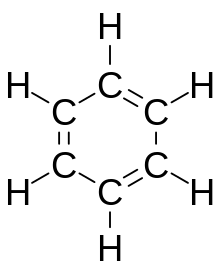
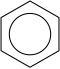
ベンゼンC6H6は6つの炭素原子が正六角形に結合し、その外側に水素原子がひとつずつ結合した環状構造をもつ。これら12個の原子はすべて同一平面上にある。
構造式は、炭素原子間の結合は二重結合と単結合が繰り返されているように書かれるが、実際は、炭素原子間の6つの結合はすべて等価であり、単結合と二重結合の中間の1.5重結合のような性質を持っている。電子密度を測定すると、ちょうど1.5重結合分であることがわかる。また、不飽和結合が環全体で共鳴しており、二重結合の位置が変化し続けていると考えることもできる。
この特徴的な環構造をベンゼン環(benzene ring)という。ベンゼン環の構造は
などと略記する。この教科書では、いずれの書き方も用いる。
製法
[編集]アセチレン()を赤熱した鉄に接触させるとベンゼンが生じる。
性質
[編集]- 特有な臭いをもち、無色で揮発性の液体(沸点80℃、融点5.5℃)である。
- 水に溶けにくく、有機化合物をよく溶かすので、有機溶媒として用いられる。
- 引火しやすい。炭素原子の割合が多いため、多量のすすを出して燃える。
- 人体には有毒で発がん性がある。
ベンゼンの置換反応
[編集]ベンゼンは、ベンゼン環の安定性のため、アルケンより付加反応を起こしづらい。だが、置換反応では、環の構造が保存されるため、ベンゼンは置換反応を起こしやすい。
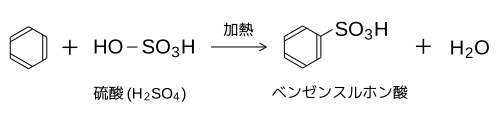
スルホン化(sulfonation)
[編集]ベンゼンスルホン酸は強酸である。
ニトロ化(nitration)
[編集]ニトロベンゼンは、無色~淡黄色の液体で、特有の甘い香りをもつ。ニトロベンゼンは、水に溶けにくく、水より重い(密度1.2g/cm3)。
ニトロベンゼンのように、炭素原子に直接ニトロ基が結合した化合物をニトロ化合物という。
ニトロ基は電子吸引性の官能基であるため、ベンゼンと化合するとベンゼンのo位とp位が正電荷を帯びて反応性が下がり、別の官能基との置換反応が起こるときにm位での置換が起こりやすい。これをメタ配向性という。フェノールに見られるオルトパラ配向性とは真逆である。
ニトロ基が多くなると爆発性を持つ。ダイナマイトに用いられるニトログリセリンや、ニトロセルロース、ピクリン酸などが好例である。
ハロゲン化(halogenation)
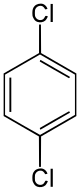
[編集]- クロロベンゼンにさらに塩素を付加すると生じるパラジクロロベンゼン(p-ジクロロベンゼン)は昇華性がある無色の固体(融点:54℃)であり、防虫剤として用いられる。
アセチル化 (acetylation)
[編集]ベンゼンと塩化アセチル(CH3COCl)を粉末状の塩化アルミニウム(AlCl3)を触媒に反応させると、ベンゼン環のHが一つアセチル基に置換され、アセトフェン(C6H5COCH3)が生じる。 [図]
アルキル化 (alkylation)
[編集]ベンゼンと塩化アルキル(R-Cl)を塩化アルミニウムを触媒に反応させると、置換反応が起こる。
例えば、クロロメタン(CH3Cl)を反応させると水素原子を一つ置換してトルエン(C6H5CH3)が生じる。トルエンは有機溶媒としてよく用いられるが、シンナーの主成分でもあるので、中毒性が高い。 [図]
ここで扱った5つ以外の置換反応はベンゼンでは起こらないと思って良い。
| 反応名 | 反応剤 | 置換 |
|---|---|---|
| スルホン化 | 濃H2SO4 | -H → -SO3H(スルホ基) |
| ニトロ化 | 濃HNO3 (触:濃H2SO4) |
-H → -NO2(ニトロ基) |
| ハロゲン化 (塩素の場合) |
Cl2 (触:Fe) |
-H → -Cl(クロロ基) |
| アセチル化 | CH3COCl (触:AlCl3) |
-H → -COCH3(アセチル基) |
| アルキル化 | R-Cl (触:AlCl3) |
-H → -R(アルキル基) |
ベンゼンの付加反応
[編集]ベンゼンでは付加反応はほとんど起こらないが、高温高圧下で触媒を用いると、水素が付加しシクロヘキサン C6H12 を生じる。
また、ベンゼンと塩素の混合物に紫外線を加えても、付加反応を起こし、1,2,3,4,5,6-ヘキサクロロシクロヘキサン(C6H6Cl6)を生じる。
1,2,3,4,5,6-シクロヘキサンはベンゼンヘキサクロリド(BHC)とも呼ばれ、かつては殺虫剤として使われていた。
芳香族炭化水素
[編集]| 名称 | 構造式 |
|---|---|
| トルエンC6H5CH3 | 
|
| スチレン | 
|
| ナフタレンC10H8 | 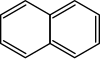
|
| アントラセン
C14H10 |
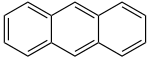
|
ベンゼン環をもつ炭化水素を
これらの化合物は芳香を持つものが多く、人体には有害なものが多い。また、ベンゼンと同様に可燃性があり、引火すると、すすを多く出して燃える。
キシレンには、2つのメチル基の位置によって3種類の異性体が存在する。

o-,m-,p- はそれぞれ、オルト、メタ、パラと読む[1]。
2つの置換基がある場合、ある置換基に対して、そのすぐ隣の位置をオルト位、1つ空いて離れた位置をメタ位、ベンゼン環を挟んで正反対の位置をパラ位と呼び、それぞれ記号o-,m-,p-をつけて異性体を区別する。
| 名称 | 融点[℃] | 沸点[℃] |
|---|---|---|
| ベンゼン | 6 | 80 |
| トルエン | -95 | 111 |
| スチレン | -31 | 145 |
| o-キシレン | -25 | 144 |
| m-キシレン | -48 | 139 |
| p-キシレン | 13 | 138 |
| ナフタレン | 81 | 218 |
| アントラセン | 216 | 342 |
側鎖の酸化反応
[編集]側鎖(ベンゼン環に結合している炭素鎖)は強力な酸化剤に晒されると全てカルボキシ基(-COOH)まで酸化される。
例えば、トルエン・エチルベンゼン・スチレンは硫酸酸性条件下で過マンガン酸カリウムと反応させると、芳香族カルボン酸である安息香酸を生じる。
同様に、o-キシレンはフタル酸、m-キシレンはイソフタル酸、p-キシレンはテレフタル酸を生じる。
トルエンのニトロ化
[編集]混酸をもちいてトルエンをニトロ化すると、o-位やp-位がニトロ化されて、ニトロトルエン C6H4(CH3)NO2 が生じる。
-
o-ニトロトルエン
-
p-ニトロトルエン
-
2,4,6,-トリニトロトルエン
さらにニトロ化すると、 2,4,6,-トリニトロトルエン(略称:TNT)が生じる。TNTは火薬の原料である。
フェノール類
[編集]| 名称 | 構造式 |
|---|---|
| フェノール | 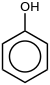
|
| o-クレゾール | 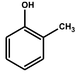
|
| m-クレゾール | 
|
| p-クレゾール | 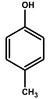
|
ベンゼン環にヒドロキシ基 -OH が直接結合したものをフェノール類(phenols)と呼ぶ。ベンゼン環に直接結合したヒドロキシ基をフェノール性ヒドロキシ基、ベンゼン環以外の炭素原子に結合したヒドロキシ基をアルコール性ヒドロキシ基という。フェノール類には、フェノールのほか、クレゾール、ナフトールなどがある。フェノール類は互いに似た性質を示す。
構造式を下に示すベンジルアルコールのように、ベンゼン環に直接ヒドロキシ基が結合しないものはフェノール類に属さない。
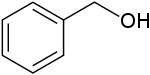
フェノール類の持つヒドロキシ基は水溶液中でわずかに電離し、弱酸性を示す。フェノール類の水溶液は、炭酸よりも弱い酸性を示す。
フェノール類は水にほとんど溶けないが、塩基水溶液と反応して塩となり水に溶ける。
ナトリウムフェノキシドの溶液に、フェノールよりも強い酸である二酸化炭素などをくわえると、フェノールが生じる。
- ナトリウムとの反応
また、フェノール類は、アルコールと同様に単体のナトリウムと反応し、水素を発生する。
検出反応
[編集]フェノール類水溶液は塩化鉄(Ⅲ) FeCl3 水溶液を加えると青紫~赤紫色を呈する。この呈色反応はフェノール類の検出に利用される。
フェノール
[編集]フェノールはベンゼン環の水素原子を1つヒドロキシ基で置換した構造である。
特有の匂いを持つ、人体には有毒な白色の固体である。石炭の乾留から得られるため石炭酸ともいう。

フェノールの合成
[編集]ベンゼンに直接ヒドロキシ基を置換することはできないが、フェノールはベンゼンを原料として様々な経路により合成することができる。中でも、工業的にはクメン法(Cummene process)が重要である。
- クメン法
- ベンゼンとプロピレンを触媒を用いて反応させ、クメンを生じる。
- クメンを酸素で酸化し、クメンヒドロペルオキシドとする。(ペルオキシドは「過酸化物」の意)
- 希硫酸により分解し、フェノールを生じる。この際、副生成物としてアセトンを生じる。
ベンゼンはアセチレンから大量生産でき、プロペンは石油から採集でき、稀硫酸も石油の脱硫で得た硫黄から接触法で安く合成できるので、クメン法もハーバーボッシュ法と同じく「安く大量生産」を目的とする工業的製法の成功例の一つである。また、副産物のアセトンも優秀な有機溶媒なので、無駄にならない。
なお、クメンヒドロペルオキシドがフェノールとアセトンに分解する過程は、マルコフニコフ則からベンゼン環が転移反応を起こすことで説明される。
他にも、ベンゼンスルホン酸のアルカリ融解や、クロロベンゼンからフェノールを合成する方法も存在する。
なお、ベンゼンスルホン酸からの製法では水酸化ナトリウムを300℃前後で融解させるので、アルカリ融解とも言われる。
また、フェノールはコールタール(石炭の乾留から生じる液体)の分留によっても得ることが出来る。
フェノールの反応
[編集]フェノールは反応性が高く、さまざまな化合物を生じる。フェノールに臭素を反応させると、ヒドロキシ基に対してオルト位とパラ位の水素原子が臭素で置換され、2,4,6-トリブロモフェノールの白色沈殿を生じる。

また、フェノールに濃硫酸と濃硝酸を作用させると、ヒドロキシ基に対してオルト位とパラ位をニトロ化してピクリン酸を生じる。ピクリン酸は、塩化鉄(Ⅲ)の呈色反応を示さない、水に可溶で電離する、強酸であると、フェノール類としては特異な性質を持っている。
芳香族カルボン酸
[編集]ベンゼン環にカルボキシル基が直接結合した化合物を芳香族カルボン酸(aromatc carboxylic acid)という。一般に、水には溶けにくいが、水中ではわずかに電離して、水中では弱い酸性を示す。
また、水酸化ナトリウムなどの塩基の水溶液と中和して、塩を生じて、水に溶ける。
芳香族カルボン酸は、医薬品や染料の原料として、よく用いられる。
安息香酸
[編集]
安息香酸は、触媒をもちいてトルエンの酸化により得られる。トルエンを二酸化マンガンを触媒として酸化するか、あるいは過マンガン酸カリウム水溶液中で加熱するかで、トルエンの側鎖 -CH3 が酸化されて安息香酸が得られる。
トルエンから安息香酸までの反応の際、おだやかな条件で酸化させると、まずトルエンのメチル基 -CH3 が酸化されアルデヒド基となり、-CHO基をもつベンズアルデヒド C6H5CHO が生じる。ベンズアルデヒドは無色であり、芳香をもち、空気中で徐々に酸化されて、しだいに安息香酸になる。
フタル酸・テレフタル酸・イソフタル酸
[編集]フタル酸 C6H4(COOH)2 はベンゼン環に2つのカルボキシル基が、互いにオルト位に結合した物質である。フタル酸は2つのカルボキシル基が近い位置にあるため、加熱により分子内脱水反応が起こり、無水フタル酸を生じる。
フタル酸の製法は、工業的には、o(オルト)-キシレンの酸化によって得られる。「オルト」とは、ベンゼン環での隣り合った位置どうしの関係のこと。
なお、バナジウムの触媒でナフタレンを酸化しても、無水フタル酸が得られる。
テレフタル酸はフタル酸の異性体であり、互いにパラ位に2つのカルボキシル基が存在する。フタル酸とは異なり、カルボキシル基が離れているため、加熱しても脱水反応は起こらない。テレフタル酸はペットボトルやワイシャツなどの素材となるPET(ポリエチレンテレフタラート)の原料である。テレフタル酸の製法は、工業的には、p(パラ)-キシレンの酸化によって得られる。
イソフタル酸もフタル酸の異性体であり、互いにメタ位に2つのカルボキシ基が存在する。イソフタル酸は、m(メタ) -キシレンの酸化によって得られる。
- [図]
サリチル酸
[編集]サリチル酸は、ベンゼン環にカルボキシル基とヒドロキシ基が互いにオルト位に結合した物質である。 サリチル酸は、ナトリウムフェノキシドから合成される。ナトリウムフェノキシドに二酸化炭素を高温・高圧下で反応させるとサリチル酸ナトリウムが作られる。そのサリチル酸ナトリウムに希硫酸を作用させると、サリチル酸が得られる。
サリチル酸は無色(白色)の結晶で、水にはわずかに溶けて酸性を示す。温水やエタノールにはよく溶ける。サリチル酸はベンゼン環に直接ヒドロキシ基が結合しているため、芳香族カルボン酸としての性質を持つと同時に、フェノール類としての性質も持つ。
サリチル酸は天然には柳の煮出汁に含まれており、痛覚を伝達する物質に化合して痛みを和らげることから、歴史的に風邪薬として用いられた。しかし、皮膚や粘膜をふやけさせる作用があることから、副作用として胃が荒れるのが常だった。現在ではその作用から、ウオノメの治療薬として用いられる。
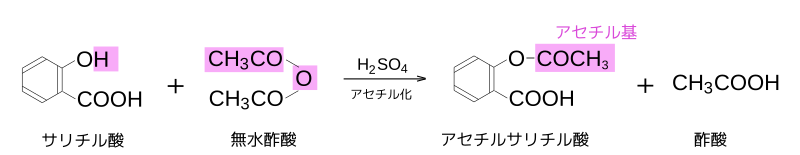
また、サリチル酸のヒドロキシ基を無水酢酸でアセチル化(アセチル基-OCOCH3での置換反応)すると、アセチルサリチル酸となる。アセチルサリチル酸は「アスピリン」とも呼ばれ、解熱鎮痛剤として広く用いられている。
サリチル酸のカルボキシル基をメタノールでエステル化すると、サリチル酸メチルとなる。サリチル酸メチルは湿布薬などに消炎剤として用いられる。
| 性質等 | アセチルサリチル酸 | サリチル酸メチル |
|---|---|---|
| 形状 | 無色の結晶(白色粉末) | 芳香性無色液体(油性) |
| 水への溶解性 | 微溶 | 難溶 |
| FeCl3による呈色反応 (フェノール性ヒドロキシ基の検出) |
示さない | 赤紫に呈色 |
| NaHCO3aqによる弱酸遊離反応 (カルボキシ基の検出) |
CO2を発生 | 示さない |
| 主な用途 | 解熱鎮痛剤 | 外用消炎剤(湿布) |
なお、某風邪薬の「半分は優しさでできている」の優しくない方がアセチルサリチル酸である。優しい方の成分は鎮痛作用こそないものの、アセチルサリチル酸による胃の炎症を抑える作用を持つ。
芳香族アミン
[編集]アンモニア NH3 の水素基を炭化水素基で置換した化合物をアミン(amine)といい、炭化水素基がベンゼン環の場合は芳香族アミン(aliphateic amine)という。
芳香族アミンは弱塩基性であり、また、アンモニアに化学的性質が似ている。
アニリン
[編集]アニリンはベンゼンの水素原子1つをアミノ基で置換した物質である。アニリンは無色油状の液体で(沸点185℃)、水に溶けにくい。アニリンを水と混ぜると、分離して下に沈む。アミノ基は弱塩基性を示すため、塩酸と反応するとアニリン塩酸塩 C6H5NH5Cl を生じて、水に溶ける。
アニリン塩酸塩に、水酸化ナトリウムのような強塩基の水溶液を加えると、油状のアニリンが遊離する。
アニリン溶液は、さらし粉の水溶液を加えると、次亜塩素酸イオンにより酸化されて赤紫色になる。この呈色反応はアニリンの検出反応として重要である。
また、アニリンを硫酸酸性二クロム酸カリウム水溶液で酸化すると黒色物質を生じる。これはアニリンブラック(aniline black)と呼ばれ、黒色染料や黒色顔料として用いられる。なお、一般にアミン・フェノールは酸化すると黒系統の色になることが知られている。
- 製法
アニリンの製法は、実験室ではニトロベンゼンから合成される。ニトロベンゼンにスズと塩酸を加えて加熱すると、還元され、アニリン塩酸塩を生じる。この水溶液に水酸化ナトリウム水溶液のような強塩基を加えて、アニリンを遊離させる。アニリンは水に溶けず分離するため、ジエチルエーテルを加えてアニリンをエーテルに溶かし抽出する。エーテル層と水層の2層に分離するため、エーテル層のみを取り出してエーテルを蒸発させると、アニリンが得られる。
アセトアニリド
[編集]アニリンに無水酢酸を作用させると、アミノ基がアセチル化され、アセトアニリド C6H5NHCOCH3 を生じる。アセトアニリドは無色無臭(白色)の固体であり、解熱鎮痛剤の原料となる。
この反応では、アミノ基とカルボキシ基との間で分子間脱水した結合-NH-CO-を生じている。この結合はアミド結合と呼ばれ、タンパク質やアミノ酸を構成する結合としても重要である。
アゾ化合物
[編集]アニリンに希塩酸を加えてアニリン塩酸塩とし、これを5℃以下に冷却しながら亜硝酸ナトリウム水溶液を少しずつ反応させると、塩化ベンゼンジアゾニウム C6H5N2+Clー とオキソニウムイオンを生じる。
このように、ジアゾニオ基-N+≡Nを含む化合物をジアゾニウム化合物と呼び、このようにジアゾニウム塩を生じる反応をジアゾ化(diazotization)と呼ぶ。なお、ジアゾ化のメカニズムの解説は高校範囲を大きく逸脱するので、興味がある人は化学系の学部に進学しよう。
塩化ベンゼンジアゾニウムは非常に不安定な物質であり、常温ではフェノールと窒素に分解してしまい、水溶液中にしか存在できない。そのため、低温に冷却して反応を進行させる必要がある。一般に、有機化合物では繊細な反応が多く、温度・質量比・濃度など様々な条件を整えないとうまく反応しないことが多い。なお、塩化ベンゼンジアゾニウムの熱分解はフェノールの合成法の一つである。
ジアゾカップリング
[編集]分子中にアゾ基 -N=N- を持つ物質をアゾ化合物(azo compound)と呼ぶ。
塩化ベンゼンジアゾニウム水溶液にナトリウムフェノキシド水溶液を加えると、p-ヒドロキシアゾベンゼン(p-フェニルアゾフェノール)を生じて橙赤色を呈する。このようにジアゾニウム塩と他の芳香族化合物からアゾ化合物を生成する反応をジアゾカップリング(diazo coupling)と呼ぶ。ジアゾカップリングも低温環境下で行う必要がある。
アゾ化合物は様々な色をもち、染料として用いられるものもある。
アゾ化合物の利用
[編集]芳香族アゾ化合物は、一般に、黄色〜赤色、橙色の化合物であり、染料(アゾ染料)や顔料として用いられる。


またメチルオレンジやメチルレッドもアゾ化合物であり、水溶液中のpHによって色が変わるので、pH指示薬として用いられているものも存在する。
芳香族化合物の分離
[編集]芳香族カルボン酸・・・炭酸水素ナトリウム と反応して水層にうつる
芳香族アミン・・・塩酸と反応して水層にうつる
フェノール類・・・水酸化ナトリウムと反応して水層にうつる(中和反応)
ベンゼン環の置換基の配向性
[編集]| オルトパラ配向性 | -OH、-CH3、-NH2、-NHCOCH3、-Cl、-Br、-OCH3 |
|---|---|
| メタ配向性 | -NO2、-COOH、-SO3H、-COCH3、-CHO |
オルト・パラ配向性
[編集]
オルト・パラ配向性の置換基のベンゼン1置換体はオルト位とパラ位での置換反応を起こしやすい。
これは、オルト・パラ配向性の置換基はベンゼン環に電子を供与するため、置換反応が起きやすくなることによる。
メチル基はオルトーパラ配向性なのでトルエンをニトロ化すると、o-ニトロトルエンまたはp-ニトロトルエンが生成する。
メタ配向性
[編集]
メタ配向性の置換基のベンゼン1置換体はオルト位とパラ位での置換反応を起こしにくいため、メタ位での置換反応を起こしやすい。
メタ配向性の置換基はベンゼン環の電子を吸引するため、置換反応が起きにくくなる。
発展:ベンゼン環の共鳴
[編集]

ベンゼンの異性体のひとつ、o-キシレンは、想像図のように2通りが考えられそうだが、じっさいには1通りしかない。
なぜなら、そもそもベンゼン環の環の部分のあいだの結合は、単結合と二重結合の中間の状態の結合になっているからである。
このように、単結合と二重結合の中間の状態の結合のある現象を共鳴という。
ベンゼン環が共鳴をしているという事は、つまり、価電子が、特定の2個の炭素原子間に束縛されず、ベンゼン環のリング全体に円周状に均等に広がって存在しているという事である。このような現象を、電子の非局在化という。この性質によりベンゼン環は安定性が高い。
ベンゼン環が共鳴していることを明記したい場合、

でベンゼン環を表記する場合もある。
共鳴してる構造式は下図のように両矢印でつないで書き、 [ ] で囲って表す。

- ^ 例えば、p-キシレンは、パラキシレンと読む。