高等学校化学I/酸と塩基の反応
酸性と塩基性
[編集]中学理科の復習
[編集]

- (※ この節『中学理科の復習』は、おもに中学理科の復習です。)
【酸の性質】
塩酸HCl 、硫酸H2SO4 、硝酸HNO3 、酢酸CH3COOH などの水溶液は、次のような性質を示す。
- 酸性水溶液とは
- 青色リトマス紙を赤色に変える。
- (BTB液を加えると黄色になる。※ 高校化学では、BTB溶液による区別は、あまり重要ではない。)
- 亜鉛、鉄などの金属と反応して水素を発生させる。
- 鉄さびなどの金属のさびを溶かす。
- 酢酸水溶液やクエン酸水溶液などは酸っぱい味がする。
このような性質を酸性(さんせい、acdic、acidity)といい、水溶液が酸性を示す物質を酸(さん、acid)という。
【塩基の性質】
水酸化ナトリウムNaOHのように、酸性の溶液に添加することで、その酸性の性質を打ち消す種類の物質がある。水酸化ナトリウムNaOH、水酸化カリウムKOH、アンモニアNH3水溶液には、つぎのような共通の性質がある。
- 赤色リトマス紙を青色に変える。
- 酸を中和する。
- BTB液を加えると青色になる。※ 高校化学では、BTB溶液による区別は、あまり重要ではない。
- 水溶液にフェノールフタレイン溶液を加えると、赤色に変わる。
このような性質を塩基性(えんきせい、basic、basicity)という。また、水溶液が塩基性を示す物質を塩基(えんき、base)という。なお、水に溶ける塩基のことを「アルカリ」といい、その水溶液が示す塩基性のことをアルカリ性という。高校化学では一般的に「塩基性」の用語のほうを用いる。
イオンで考えると
[編集]【酸】
塩化水素HClや硫酸H2SO4は、つぎのようにイオンに電離(でんり)している。
- HCl → H+ + Cl−
- H2SO4 → 2H+ + SO42−
なお、酸や塩基にかぎらず、物質が陰イオンと陽イオンに分かれる現象のことを電離(でんり)という。
塩酸も硫酸も、両方とも、水溶液中に電離したときに、H+が発生している。なので、このH+イオンが、酸性の原因であると推測できる。実際に、H+イオンは酸性の原因である。
【塩基】
水酸化ナトリウムや水酸化カルシウムなどは、水溶液中では、つぎのように電離している。
- NaOH → Na+ + OH−
- Ca(OH)2 → Ca2+ + 2OH−
このことから OH− イオンが、水溶液に塩基性を示させる原因であることが分かり、実際に OH− が塩基性の理由である。しかしアンモニアNH3は分子中にOHを持ってないのに、水溶液が塩基性を示す。アンモニア水溶液が塩基性を示す理由は、解けたアンモニアの一部が水分子と反応し、その際、水分子がもとになって OH が発生するからである。 つまり、アンモニアの場合、
- NH3 + H2O → NH4+ + OH−
と電離する。
アレニウスの酸・塩基の定義
[編集]1887年、スウェーデンの化学者アレニウスは、酸と塩基を次のように定義した。
「酸とは、水に溶けて水素イオンH+を生じる物質であり、塩基とは、水に溶けて水酸化物イオン OH− を生じる物質である。」
塩化水素HClや硫酸H2SO4や酢酸CH3COOH などは、水溶液中で次のように電離して、水素イオン H+ を生じる。
- HCl → H+ + Cl−
- H2SO4 → 2H+ + SO42−
- CH3COOH → CH3COO- + H+
オキソニウムイオン
[編集]アレニウスの酸の定義の提唱よりも後の研究では、水素Hは単独で塩基と電荷のやりとりを生じているのではなく、オキソニウムイオン H3O+ として、電荷の授受をしていることが明らかになった。たとえば、塩化水素の場合は以下の様な式である。
- HCl + H2O H3O+ + Cl−
しかし書式では、簡略化のため、特別にオキソニウムイオン(oxonium ion)を強調したい場合を除いて、酸の水素イオンは単にH+と書くことが多い。一般の検定教科書や参考書や学術書でも、特別にオキソニウムイオン(oxonium ion)を強調したい場合を除いて、酸の水素イオンは単にH+と書くのが普通だし、検定教科書でも、そのことを説明している。
ブレンステッドの酸・塩基の定義
[編集]アレニウスによる酸と塩基の定義の後、彼の定義では例外の物質があり、不都合なことが分かってきた。たとえば、アンモニアNH3は分子中には水酸基OHを含んではいないが、塩酸HClなどの酸を中和する能力をアンモニアは持ち、明らかにアンモニアは塩基性を持つと見なせることが分かってきた。このような例に基づき、そこでデンマークの化学者ブレンステッドは、アレニウスの酸・塩基を拡張して、1923年に、次のように酸と塩基を定義した。
「酸とは、水素イオンH+を与える分子・イオンである。塩基とは、水素イオンH+を受け取る分子・イオンである。」
なお、水素イオンのことをプロトン(proton)という場合がある。
今日における、酸と塩基の化学上の定義は、このブレンステッドの定義に近い定義である。 ブレンステッドの定義によると、塩酸HClが水H2Oに溶解して電離する反応 では、水H2Oは水素イオンを受け取りオキソニウムイオンになるので、水H2Oを塩基と見なせる。
- HCl + H2O H3O+ + Cl-
いっぽう、アンモニアが水に溶解して電離する反応では、水H2Oは、アンモニアに水素イオンを提供し、水酸化イオンOH-になるので、水は酸と見なせる。
- NH3 + H2O NH4 + OH-
このような例から、ブレンステッドの定義では、水は反応する相手によって酸か塩基かが変わる両性物質になる。
価数
[編集]- 酸の価数
酸では、化学式中に含まれる水素原子のうち、H+イオンになることのできる水素原子数を酸の価数(かすう、degree)という。たとえば塩化水素HClの価数は1である。硫酸H2SO4の価数は2価である。(※ なお、「1価」は「いっか」と読む。「2価」は「にか」と読む。)
酢酸CH3COOHの場合、CH3の基の部分のイオンにはならず、酢酸でイオンになるのはCOOHの部分に含まれる水素Hのみであるので、酢酸の価数は1価である。
- CH3COOH → CH3COO- + H+
塩化水素と酢酸は、酸の強さが異なるが、ともに1価の酸である。このことから分かるように、価数と、酸・塩基の強弱とは、別の概念である。
| 価数 | 酸 | 化学式 |
|---|---|---|
| 1 | 塩化水素 | HCl |
| 酢酸 | CH3COOH | |
| 硝酸 | HNO3 | |
| 2 | 硫酸 | H2SO4 |
| シュウ酸 | (COOH)2 | |
| 炭酸 | H2CO3 | |
| 3 | リン酸 | H3PO4 |
- 塩基の価数
塩基では、化学式中に含まれる水酸化物イオンOH-の数を塩基の価数という。または塩基1化学式が受け取ることができるH+イオンの数ともいえる。例として、水酸化ナトリウムNaOHは1価の塩基である。水酸化カルシウムCa(OH)2は2価の塩基である。
アンモニアは水溶液中では
- NH3 + H2O NH4 + OH-
のように電離して、アンモニア1分子につき OH- 1個を生じるため、アンモニアは1価の塩基に分類される。
| 価数 | 酸 | 化学式 |
|---|---|---|
| 1 | 水酸化ナトリウム | NaOH |
| 水酸化カリウム | KOH | |
| アンモニア | NH3 | |
| 2 | 水酸化カルシウム | Ca(OH)2 |
| 水酸化バリウム | Ba(OH)2 | |
| 水酸化銅(II) | Cu(OH)2 | |
| 水酸化マグネシウム | Mg(OH)2 | |
| 3 | 水酸化鉄(III) | Fe(OH)3 |
| 水酸化アルミニウム | Al(OH)3 |
- 多価
酸や塩基において、価数が2価や3価など、価数が2以上の場合を「多価」という。
酸・塩基の電離度
[編集]塩酸と酢酸は、ともに1価の酸であるが、同じモル濃度のこれらの酸に亜鉛を加えると、塩酸のほうが酢酸より激しく水素を発生する。この反応は、イオン反応式
- Zn + 2H+ → Zn2+ + H2
で表されれるが、H+イオンの濃度は、塩酸のほうが非常に大きいためである。
水に溶けて陽イオンと陰イオンを生じる物質を「電解質」(でんかいしつ、electrolyte)という。電解質の水溶液で溶けている電解質全体の物質量に対して、そのうち電離している電解質の物質量の割合を電離度(でんりど、degree of ionization)という。
例として、塩化水素の電離度は、ほぼ1である。 酢酸の電離度は、その濃度や温度によっても変わるが、酢酸の電離度は、だいたい0.01くらいであり、このように、かなり電離度が小さい。
- CH3COOH → CH3COO- + H+
このように、その酸・塩基の強さが、電離度の大小から、だいたいは酸・塩基の強弱が分かる。
電離度αを式であらわせば、
電離度α= (電離した電解質の物質量)/(溶解した電解質の物質量)
である。電離度αの値は 0<α≦1 である。
電離度は温度や濃度によって変わる。一般に、濃度が小さいほど電離度が大きくなる。また、温度が高いほど、電離度が大きくなる。
酸・塩基の強弱
[編集]塩化水素や水酸化ナトリウムは、濃度が大きいときでも、電離度が1に近い。
このように、電離度が1に近い酸や塩基を、それぞれ強酸(きょうさん)あるいは強塩基(きょうえんき)という。
いっぽう、酢酸やアンモニアなどのように、溶質のほとんどが電離していない酸または塩基を、それぞれ弱酸または弱塩基という。
酸・塩基の価数は、酸・塩基の強弱には関係しない。
- 強酸と弱酸
酸の強さの定量化は、電離度を用いて定量化ができる。塩酸HClや硫酸HNO3などは電離度が、塩酸の電離度は約0.9、硝酸の電離度は約0.9、などと電離度が1に近く、このように電離度の大きい酸を強酸(きょうさん、strong acid)という。 いっぽう、酢酸CH3COOHの電離度は0.01程度と非常に小さく、このように電離度の小さい酸を弱酸(じゃくさん、weak acid)という。
まとめると、
| 強酸 | HCl、HBr、HI、HNO3、H2SO4 |
|---|---|
| 弱酸 | HF、CH3COOH、H2S、CO2、(COOH)2 |
- 強塩基と弱塩基
塩基の強さについても、電離度を用いて定量化される。水酸化ナトリウムNaOHの電離度は約0.9であり、水酸化カリウムKOHの電離度は約0.9である。これら水酸化ナトリウムのように、電離度の大きい塩基を強塩基(strong base)という。アンモニアは電離度の観点からは、アンモニアの電離度が約0.01と低い。アンモニアのように電離度が低い塩基を弱塩基(weak base)という。
| 強塩基 | NaOH、KOH、Ca(OH)2、Ba(OH)2、 |
|---|---|
| 弱塩基 | NH3、Mg(OH)2、Cu(OH)2、Fe(OH)3 |
なお、強酸や強塩基のように電離度の高い電解質のことを「強電解質」という。 また、弱酸や弱塩基のように電離度の低い電解質のことを「弱電解質」という。
酸・塩基の強弱の測定
[編集]水の電離
[編集]純水は、わずかであるが電離をしていて、水素イオン H+ と水酸化物イオン OH- を生じている。
このとき、水素イオン濃度 [H+] と水酸化物イオン濃度 [OH-] は等しく、25℃では濃度はいずれも 1.0×10-7 mol/l となっている。 つまり、
- [H+] = [OH-] = 1.0×10-7 mol/l
が25℃での純水のイオン濃度の状態である。
酸性の溶液では、 [H+] のほうが多くなり、
である(温度は25℃とした)。
塩基性の溶液では、[OH- のほうが多くなり、
である(温度は25℃とした)。
水素イオン濃度
[編集]水溶液の酸性は、水素イオン濃度[H+]が大きいほど強くなり、塩基性は水酸化物イオン濃度[OH-]が大きいほど強くなる。
[H+]の値は広い範囲で変化するため、扱いにくい。そこで、[H+]が1×10-nのときのnの値で表すのだが、このnを、その水溶液の pH という。pHの読みは「ピーエイチ」またはドイツ語読みで「ペーハー」と読む。日本語訳ではpHのことを「水素イオン指数」(hydrogen ion exponent)ともいう場合もあるが、日本でも実用的にはpHで表す場合が多い。
- さまざまな物質のpHの具体例
たとえばレモンは、おおよそpH=2からpH=3である。
胃液のうち、胃酸はだいたいpH=2である。
胃液には炭酸水素ナトリウム(重曹)、胃酸があるが、胃酸には塩酸が含まれている。
胃酸は通常、胃内部の食物に触れる事なく胃小窩へ落ち込み、排泄されることとなる。
(胃の主な分泌液は炭酸水素ナトリウムである。炭酸水素ナトリウムを造る時に発生する副産物が胃酸である)
雨水はじつは弱酸性であり、雨水はpH=6くらいである。
牛乳は、pH=7である、血液はpH=7である。
人の静脈血は、pH=7.365
同じく動脈血は、pH=7.4
また、血液量の4倍量あるとされる間質液、および小腸は、pH8.3~8.4である。
間質液により血液pHの維持が可能となる。
小腸内のpH環境を保つために胃内壁から炭酸水素ナトリウムが生成・分泌されている。
いっぽう、セッケン水はpH=9からpH=10である。
雨水が酸性の理由は、おもに、空気中の二酸化炭素CO2によるものである。このほか、石炭や石油などの排煙にふくまれる窒素や硫黄などにより、一酸化窒素NOや二酸化窒素NO2、硫黄酸化物SO2が発生するのだが、これらが雨水の酸性の原因になっている。
- ※ もし読者が数学の「対数」(たいすう)の log(ログ、ロガリズム) を知ってるなら、pHとは、常用対数をとって、それに負符号を付けたものを用いて、酸性/塩基性の程度を表したものである。高校2年の数学IIあたりで「対数」を習う。もし読者がまだ1年生で習ってなければ、この文は読み飛ばしても良い。
- 対数の式でpHの定義を表せば、
- である。
pHの値がpH=7ならば中性である。 pHの値は塩基性になるほどpHが高くなる。pHが7より高いpH>7の状態では塩基性である。pHがとりうる最大値は理論上では14である。pH=14のときは、 [H+]=10-14 である。
pHの値は酸性になるほどpHが低くなる。pHが7より低いpH<7の状態では酸性である。pHがとりうる最大値は理論上では0である。pH=0のときは、 [H+]=100=1 である。
なお、水酸化イオン[OH-]の対数をとったものをpOHという。(「ピー オーエイチ」と読む) 特別な理由がないかぎり、あまり[OH-]で酸性/塩基性のていどを表すことはせず、普通の場合はpHで酸性/塩基性のていどを表す。
pHとpOHについて、イオン積により、次の公式が成り立つ。
- pH + pOH =14
あるいは
- pH =14 - pOH
イオン積
[編集]水の電離のさい、[H+]と[OH-]の積の値は、温度一定なら、積 [H+][OH-] も一定値となる。この値を水のイオン積(ion product of water)といい、Kwで表す。イオン積Kwは以下の関係にある。
- [(mol/l)2]
25℃では(mol/l)2である。
したがって、これらをまとめれば、
- [(mol/l)2]
である(25℃の場合)。
たとえば、ある水溶液で、[H+]が10倍になると、[OH-]は10分の1になる。
このイオン積の値が成り立つのは、水だけでなく、酸や塩基や他の中性の水溶液でも同様に、水素イオンと水酸化イオンとのイオン積は一定で、1.0×10-14 [mol2/l 2]が成り立つ。また、値の1.0×10-14 [mol2/l 2]は常温付近での値であり、温度がかわると少しだけ値が変わるが、常温付近ならば桁の10-14のところまでは変わらないので、実用上は一定値1.0×10-14 [mol2/l 2]と見なすことが多い。
このやといったイオン濃度の概念を用いると、水溶液における酸性の定義や塩基性の定義を以下のように数値的に定義できる。
水溶液における酸性とは、水素イオン濃度が水酸化イオンよりも大きい状態である。
- 酸性:
同様に、水溶液の中性や塩基性も、イオン濃度で定義できる。
- 中性:
- 塩基性:
pHの測定
[編集]pH指示薬
[編集]
物質の中には、水溶液に接触させた時に、水溶液のpHの値によって色が変化するものがある。このような物質はpHを調べるのに用いることができるので、これらの物質のうちpHを調べる物質として実用化されている物質をpH指示薬(pH indicator)という。いわゆるリトマス試験紙もpH指示薬に含まれる。
pH指示薬は、その物質によって、色を変えるpHの範囲が限られている。たとえば、メチルオレンジはpH=3.1以下では赤色で、そこからpHが高くなると黄色味を増していき、pH=4.4では橙黄色である。pH=4.4より高いpHでは橙黄色のまま、ほとんど色が同じなので、このpHの範囲では指示薬として用いられない。 このように指示薬の色が変わるpHの範囲を変色域(へんしょくいき、transitional interval)という。
BTB溶液も、pH指示薬である。なお「BTB」とは「ブロモ チモール ブルー」の略である。BTB溶液の変色域は 6.0〜7.6である。(pH=6.0あたりからpH=7.6あたりまで、という意味。)
ファノールフタレインの変色域は 8.0 〜 9.8 である。
メチルオレンジの変色域は、 3.1 〜 4.4 である。
なお、リトマス試験紙のように、pH指示薬を試験用の紙に染み込ませて用いる事が多い。このようなpH指示薬を染み込ませてある紙をpH試験紙(pH indicator paper)という。
pHメータ
[編集]pHを正確に測定するには、電位差を測定する方法が用いられる。そのための測定機器としてpHメータがある。
中和
[編集]中和
[編集]中学卒業までに習ったように、酸と塩基が反応して、たがいの性質を打ち消しあうことを中和(ちゅうわ、neutralization)という。
これは、イオンの観点からみれば、酸から生じる H+ と、塩基から生じる OH- が結びついて H2O となる変化である。
たとえば、塩酸HClと水酸化ナトリウムNaOH水溶液の中和反応は、次のように表される。
- HCl + NaOH → NaCl + H2O
また中和後の反応液を蒸発させると、塩化ナトリウムNaClの結晶が得られる。
NaClのように、中和反応で生じる酸の陰イオンと塩基の陽イオンとからなる化合物を塩(えん、salt)という。
中和反応は、次のようにまとめられる。
- 酸 + 塩基 → 塩 + 水
中和滴定
[編集]
濃度不明の酸の濃度を測りたいときは、濃度が分かっている塩基で、中和反応に要した溶液の体積をもとに、酸の濃度を測定できる。
つまり、ある酸と塩基が、過不足なく中和しあうとき、
- 酸から生じる [H+] の物質量 = 塩基から生じる [OH-]の物質量
の公式が成り立つ。
さて、酸の溶液が、酸の価数がa価で、モル濃度c[mol/l]で、体積v[mL]とする。塩基の溶液が、価数はb価でモル濃度c'[mol/l]で体積v'[mL]とする。
すると、本節冒頭の説明とまとめれば、
- acv=bc'v'
である。
この原理を用いて、濃度不明の酸の濃度を測るときは、濃度が分かっている塩基で、中和反応に要した溶液の体積をもとに、酸の濃度を測定できる。
同様に、濃度不明の塩基は、濃度が分かっている酸があれば、中和反応に要した溶液の体積をもとに、塩基の濃度を測定できる。
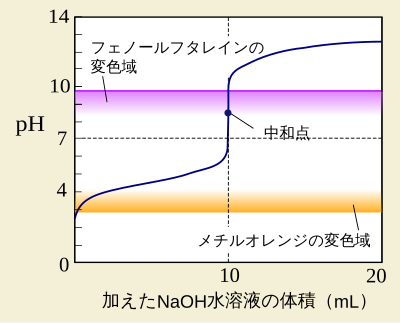
このように、中和反応に要した溶液の量をもとに、濃度が未知の酸または塩基の濃度を測定することを中和滴定(ちゅうわ てきてい)という。そして測定結果の、加えた溶液の体積と、pHとの関係を右図のようにグラフにしたものを滴定曲線(てきていきょくせん、titration cureve)という。
滴定曲線などで、ちょうどピッタリと中和するところを中和点(ちゅうわてん、neutrakization point)という。中和のさい、中和点の付近でpHが急激に変わる。
中和点のさいの加えた溶液の体積をなるべく正確に知るため、指示薬が必要である。その中和点のための指示薬として、フェノールフタレイン(略称:PP)とメチルオレンジ(略称:MO)の両方が、中和滴定では、よく用いられる。
メチルレッドやブロモチモールブルーを用いる場合もある。
なお、中和点のpHは、必ずしも7とは限らない。中和で生じた塩が水と反応して、酸性または塩基性を示す場合があるから、である。
- 弱酸の滴定
たとえば弱酸である酢酸を、強塩基である水酸化ナトリウムで滴定すると、中和であらわれる塩が塩基性であるため、滴定曲線の中和点が pH=7〜11 と塩基性側に偏る(かたよる)。
また、メチルオレンジは、酢酸水溶液の滴定では、中和する前に色が大きく変わってしまうため、メチルオレンジは酢酸水溶液では指示薬として不適である。フェノールフタレインは変色域を塩基性側に持つため、酢酸水溶液の滴定でもフェノールフタレインは指示薬として使える。
- 弱塩基の滴定
いっぽう、弱塩基であるアンモニアを、塩酸のような強酸で滴定すると、中和点のpHが酸性側に偏る。中和点付記のpHの変化は3〜9である。この場合、フェノールフタレインは指示薬として不適当である。いっぽう、メチルオレンジは変色域を酸性側に持つため、指示薬として使える。
中和滴定に用いる道具
[編集]- 使用する溶液で洗う道具
- ホールピペット
- ビュレット
なお、使用する溶液で洗うことを共洗い(ともあらい)という。 もし水で洗うと、その水が測定中の溶液にまざってしまうので、測定結果が変わってしまうからである。
- 純水で洗って濡れたままでよい道具
- メスフラスコ
- コニカルビーカー
これらの道具は、測定値を確定したあとの液体を集めるための道具なので、水が混ざっても、測定値の確定には影響しない。
pH指示薬
[編集]- 強酸+強塩基 中和点は中性
- フェノールフタレイン
- メチルオレンジのいずれでもよい
- 弱酸+強塩基 中和点は弱塩基性
- フェノールフタレインのみ
- 強酸+弱塩基 中和点は弱酸性
- メチルオレンジのみ
塩
[編集]塩の分類
[編集]NaHSO4は、水酸化ナトリウム NaOH と硫酸 H2SO4 の中和反応からなる塩には、硫酸ナトリウム Na2SO4 と 硫酸水素ナトリウム NaHSO4 の2種類がある。
このうち、硫酸水素ナトリウム NaHSO4 のように、組成に酸のHが残っている塩を酸性塩(さんせいえん、acid salt)という。いっぽう、硫酸ナトリウム Na2SO4 のように、組成に酸のHも塩基のOH含まない塩を正塩(せいえん、normal salt)という。
- 酸性塩
- 酸と塩基が化合した塩のうち、硫酸水素ナトリウム NaHSO4 や 炭酸水素ナトリウム NaHCO3 のように、組成に酸のHが残っている塩を酸性塩(さんせいえん、acid salt)という。
なお、水溶液が酸性かどうかは、酸性塩の定義とは無関係である。たとえば炭酸水素ナトリウム NaHCO3は酸性塩だが、その水溶液は弱い塩基性である。なお、硫酸水素ナトリウム NaHSO4の水溶液は酸性である。
- 塩基性塩
- 組成に塩基のOHが残っている塩を塩基性塩(えんきせい えん、basic salt)という。
塩化水酸化マグネシウム MgCl(OH) は、水酸化マグネシウム Mg(OH)2 と塩化水素 HCl から生じた塩のうち、水酸化マグネシウムの OH が残っている塩である。
- 正塩
- 塩化ナトリウム NaCl のように、組成に酸の H も塩基の OH も含まない塩を正塩(せいえん、normal salt)という。
塩化ナトリウムは、水酸化ナトリウム NaOH と塩化水素 HCl との塩である。
例 NaCl、NH4Cl、CH3COONa
'注意' この分類は、塩の水溶液の液性とは無関係なので要注意。
例
- NaHCO3は、酸性塩だが水溶液は塩基性。
- NH4Clは、正塩だが、水溶液は酸性。
塩の加水分解
[編集]酢酸 CH3COOH と水酸化ナトリウム NaOH の中和で生じる酢酸ナトリウム CH3COONa の水溶液は、塩基性である。
このように、一般に、弱酸と強塩基からなる塩の水溶液は、塩基性を示す。
こうなる理由は、弱酸は電離度は小さく、強塩基は電離度が大きいからである。
CH3COONa が水に溶けると、いったん CH3COO- と Na+ に分解するが、弱酸は電離度が小さいため、ほとんどは水溶液中の H+ と反応して、酢酸分子CH3COOH に戻ってしまう。いっぽう、強塩基は電離度が大きいので、ほとんどは電離したままなので OH- は減らない。
このため、水溶液中の H+ が減り OH- が増えるので、水溶液が塩基性になる。
この現象を化学式でまとめると、いったん
と分解してから
という結合が起きたという現象になる。
このように、電離して生じたイオンが水溶液と反応して、水溶液が酸性または塩基性になる反応を、塩の加水分解(かすい ぶんかい、hydrolysis)という。なお、塩化ナトリウムが水溶液に溶けて中性になる時のような場合は、加水分解とは呼ばない。
塩化アンモニウム水溶液は、弱塩基のアンモニアと強酸の塩酸からなる塩である。塩化アンモニウムの水溶液は、酸性である。
こうなる理由は、弱塩基は電離度が小さく、強酸は電離度が大きいからである。 NH4Cl の多くは、水分子に H+ を与えて、自身はアンモニア NH3 分子になる。いっぽう、強酸のHClは電離したままである。 この結果、水溶液中に H+ が多くなるので、よって酸性の水溶液になる。
このように、弱塩基と強酸の塩による水溶液は、一般に、酸性である。
塩化アンモニウムの水溶液の反応を化学式にすると、
である
- 強酸と強塩基からなる塩
塩化ナトリウム NaCl のように、強酸と強塩基からなる正塩の水溶液は、中性である。よって、強酸と強塩基からなる塩は、加水分解しない。
- 強酸と強塩基からなる酸性塩または塩基性塩
正塩以外の場合は、つまり酸性塩または塩基性塩の場合なら、たとえ強酸と強塩基からなる塩でも、水溶液が酸性または塩基性の場合もある。たとえば硫酸水素ナトリウム NaHSO4 は強塩基 NaOH と強酸のH2SO4 からなる塩であり、硫酸のH が残ってるので酸性塩であるが、その水溶液は酸性である。
- 酸性塩の水溶液
炭酸水素ナトリウム NaHCO3 は酸性塩だが、この塩 NaHCO3 は、弱酸の炭酸 H2CO3 と強塩基 NaOH からなる。さきほど説明した「弱酸と強酸との塩の水溶液は、塩基性」の原則どおりに、炭酸水素ナトリウム NaHCO3 の水溶液は塩基性である。
硫酸水素ナトリウム NaHSO4 の水溶液は、さきほど説明したように、酸性を示す。
弱酸・弱塩基の遊離
[編集]- 弱酸の塩と強酸の反応
CH3COONa のような弱酸と強塩基の塩に、 HClのような強酸を加えると、弱酸が遊離する。
- CH3COONa + HCl → CH3COOH + NaCl
- 弱塩基の塩と強塩基の反応
塩化アンモニウム水溶液と水酸化ナトリウムでは、弱塩基が遊離するため、アンモニアが発生する。
- NH4Cl + NaOH → NaCl + H2O + NH3
多段階電離
[編集]溶液中で、多価の酸が水素イオンを電離するときは、段階的に1個ずつ水素イオンを電離をしている。 たとえば2価の酸である硫酸では、以下のように電離をする。
- H2SO4 → H+ + HSO4- (第1段階)
- HSO4- → H+ + SO4- (第2段階)
このように段階的に多段階に電離することを、多段階電離という。 一般に、多価の酸の電離度は、第2段階以降の段階の電離度と比べて、第1段階の電離度がもっとも大きい。 硫酸の場合も第一段階の電離度が、もっとも大きい。
- 多価の塩基の場合
いっぽう、多価の塩基が電離するときについては、事情が異なる。たとえばイオン結晶である水酸化カルシウムCa(OH)2の水に溶けて生じた電離では、1段階でまとめて電離をする。
- Ca(OH)2 → Ca2+ + 2(OH)-
二段階中和
[編集]
炭酸ナトリウムNa2CO3は塩(えん)である。炭酸ナトリウムの水溶液は塩基性を示す。
炭酸ナトリウムに塩酸などの強酸をくわえていくと、2段階の中和反応を起こす。
- Na2CO3 + HCl → NaCl + NaHCO3 (1)
- NaHCO3 + HCl → NaCl + H2O + CO2 (2)
(1)の反応が終了してからでないと、(2)の反応が起こらない。
この反応の滴定曲線は、図のように、pHが2か所で大きく変化する。その理由は(2か所でpHが急変する理由は)、反応が(1)と(2)の二段階で起きるからである。
第一中和点(pH=8.5付近)はフェノールフタレインの変色(赤色→無色)で判定できる。第二中和点の付近では溶液が、反応式(1)からも分るように、塩化ナトリウムと炭酸水素ナトリウムとの混合液になっている。
第二中和点(pH=3.5付近)はメチルオレンジの変色(黄色→赤色)で判定できる。第二中和点の付近では溶液が、反応式(2)からも分るように、塩化ナトリウムと炭酸(二酸化炭素)との混合液になっている。



![{\displaystyle \mathrm {[H^{+}]>1.0\times 10^{-7}>[OH^{-}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/da91ac65d32a6ef079093673895db25ccc74f75c)
![{\displaystyle \mathrm {[H^{+}]<1.0\times 10^{-7}<[OH^{-}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/15bf4fc9f9907c69de45d421b8eff99bc5900586)
![{\displaystyle \mathrm {pH=-\log _{10}[H^{+}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/34c614f1303e11326125b301b32ac89508627a63)
![{\displaystyle K_{\mathrm {w} }=K\mathrm {[H^{+}][OH^{-}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b59f7866f4ac158c50da3659f993799b7fda997)

![{\displaystyle K_{\mathrm {w} }=K\mathrm {[H^{+}][OH^{-}]} =1.0\times 10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c086f0dd16d7bc3e990b110e994fbe9456eeee2b)
![{\displaystyle \mathrm {[H^{+}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ffd28eace83289203a5c1cde0d6974ba83251b2)
![{\displaystyle \mathrm {[OH^{-}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a821890ee70744107579fb54d494aad50fe5043f)
![{\displaystyle \mathrm {[H^{+}][OH^{-}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/87b1ea8f08be0c4aa90559f83e3c86e7874cf57e)
![{\displaystyle \mathrm {[H^{+}]} >\mathrm {[OH^{-}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c09c6c663315d51e775685430027480edb237bf)
![{\displaystyle \mathrm {[H^{+}]} =\mathrm {[OH^{-}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/db49b1fea1a39537f3582b6101b917ebee18aa24)
![{\displaystyle \mathrm {[H^{+}]} <\mathrm {[OH^{-}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/645f44ebaea7d23e1f15b53d73f840906ac9f310)



