高等学校生物/生物II/遺伝情報の発現
導入
[編集]ヒトのDNAは塩基数が約30億個であり、遺伝子は約2万個と考えられている。(暗記しなくていい。)
DNAからアミノ酸合成までの化学的な仕組み
[編集]DNAの半保存的複製の検証
[編集]
DNAの複製では、2本鎖が1本ずつに別れ、それぞれ鋳型になって複製される。これをDNAの半保存的複製(はんほぞんてきふくせい、semiconservative replication)という。
DNAの半保存的複製の仮説は、メセルソンとスタールの実験で証明された。
- メセルソンとスタールの実験
まず、基準として、あらかじめ通常の窒素14Nをふくむ培地で、大腸菌を培養しておく。この基準とはべつに、もう一種類、重窒素15Nをふくむ培地を、次のように用いる。
(1) 大腸菌を培養する際、区別のため、重窒素15Nをふくむ塩化アンモニウム(15NH4Cl)を窒素源とする培地で、培養して増殖させる。
すると、大腸菌の窒素原子に、すべて重窒素15Nだけをふくむ大腸菌が得られる。
まず、この大腸菌を保存しておく。理由は、もうひとつの基準とするため。
(2) さらに、15Nだけをふくむ大腸菌を、ふつうの窒素14Nをふくむ培地に移して培養して、分裂1回目・2回目・・・といった分裂ごとにDNAを抽出するため遠心分離機で遠心分離して、DNAの比重を調べる。
結果
・ 1回分裂後のDNAからは、15Nと14Nを半々にふくむDNAだけが得られ、重さは中間の重さだった。
・ 2回分裂直後のDNAからは、15N-14Nの半々のDNAと、14NだけをふくむDNAが、1:1の割合で得られた。 重さは、14NだけをふくむDNAが、もっとも軽い。
 |
 |
・ 3回目の分裂後は、軽いDNAと中間の重さのDNAの比が3:1だった。
・ 4回目の分裂後は、軽いDNAと中間の重さのDNAの比が7:1だった。
・ n回目の分裂後は、軽いDNAと中間の重さのDNAの比が 2n-1:1 だった。
中間の重さのDNAは、何世代たっても消滅しなかった。
この実験によって、DNAの半保存的複製は証明された。
アカパンカビのアルギニン要求株
[編集]
アカパンカビは、糖といくつかのビタミンなどを加えただけの培地(最小培地、minimal medium)で育成できる。アメリカのビードルとテータムは、アカパンカビにX線や紫外線などの放射線を当てて、DNAを変化させ、突然変異させた。
突然変異したものの中には、最小培地だけの栄養素では増殖できず、さらに他の栄養素も必要とする株が生じた。このような最小培地の他の栄養素も要求する株を栄養要求株という。
アルギニンを加えないと増殖できない株をアルギニン要求株という。このアルギニン要求株には、実験の結果、次の三種類あることが分かった。
| 最小培地 | 最小培地 +オルニチン |
最小培地 +シトルリン |
最小培地 +アルギニン | ||
|---|---|---|---|---|---|
| アルギニン 要求株 |
1 | - | ○ | ○ | ○ |
| 2 | - | - | ○ | ○ | |
| 3 | - | - | - | ○ | |
| 野生株 | ○ | ○ | ○ | ○ | |
- アルギニンかシトルリンかオルニチンの、どれか一種以上を与えれば育つ株。
- アルギニンかシトルリンの、どれか一種以上を与えれば育つ株。
- アルギニンを与えないと育たない株。
このことから、
- オルニチン → シトルリン → アルギニン
という、なんらかの順番が予想される。答えを言うと、これはアカパンカビによるアミノ酸の合成の順番である。
アカパンカビのアミノ酸合成で、グルタミン酸を材料に、
- グルタミン酸 → オルニチン → シトルリン → アルギニン
というふうに合成していく。グルタミン酸からオルニチンを合成し、オルニチンを材料にシトルリンを合成し、シトルリンを材料にアルギニンを合成していく。
そして、それぞれのアミノ酸を合成する酵素は、それぞれ別の酵素である。グルタミン酸からオルニチンを合成する酵素(仮に酵素Aとする)があり、オルニチンからシトルリンを合成する酵素(仮に酵素B)があり、シトルリンからアルギニンを合成する酵素(仮に酵素C)がある。
そして、これらは遺伝子の突然変異によるものだった。つまり、それぞれの酵素は、遺伝子が異なる。
酵素Aに対応する遺伝子Aがあり、それとは別に、酵素Bに対応する遺伝子Bがあり、それとは別に、酵素Cに対応する遺伝子Cがあることになる。
ビードルとテータムは、このような考察をもとに、「1つの遺伝子は、対応する特定の1つの酵素の合成を支配する。」という一遺伝子一酵素説(いちいでんし いちこうそせつ)を立てた。
現代では、さらに一遺伝子一ポリペプチド説へと拡張された。「1つの遺伝子は、対応する特定の1つのポリペプチドの合成を支配する。」というような説である、
もっとも、実際には選択的スプライシングによって、1つの遺伝子が、複数のポリペプチドに対応することもある。
ともかく、遺伝子は、ポリペプチドの合成を支配しているのが原則だろうと考えられている。
DNAの方向性
[編集]

DNAの方向の定義は、デオキシリボースの五炭糖の炭素原子にもとづき、鎖の末端が5´の端部と、鎖の反対側の末端の3´の端部がある。3´の部分には水酸基OHが、もとから付いている。 この5´と3´の位置にもとづき、DNAの二本鎖のそれぞれ一本ずつの方向が定義される。なので、向かいあってるDNAの二本鎖は、定義にもとづき方向が逆となる。
DNAの片方の鎖の5´側の末端(つまりリンPがある側の末端)を、5´末端(5´ terminal)という。同様に、3´側の末端(つまり水酸基OHがある側の末端)を、3´末端(3´ terminal)という。
岡崎フラグメント
[編集]
DNAを合成する酵素であるDNAポリメラーゼは、一方向にしか合成できない。このため、もう一方の鎖の合成は、合成前でのDNAのほどけていく向きとは逆向きに進行する。 このため、逆向きに合成するほうは、細切れの断片ずつでDNAを合成していく。そしてDNAリガーゼという酵素が断片をつないでいく。
ほどけていく向きと同じ向きに新しく合成される鎖をリーディング鎖(リーディングさ、leading strand)という。 ほどけていく向きと反対向きに合成される鎖をラギング鎖(ラギングさ、laging strand)という。 そして、ラギング鎖のそれぞれのDNA断片を、発見者の名前にちなんで岡崎フラグメント(Okazaki fragment)という。
DNAポリメラーゼがデオキシリボースの3´末端の位置に新たにヌクレオチドを付け加えていくことで、DNAは伸長される。伸長の方向について新生鎖を基準にすると、DNAの合成は5´から3´の方向へと合成していく。この5´→3´という方向に合成する法則は、リーディング鎖とラギング鎖ともに共通である。
ただしラギング鎖では断片がいくつもできから、3´に近い断片ほど、古くに合成された断片である。なので、長期的に見るとラギング鎖の合成方向が、新生鎖を基準にすると、まるで3´から5´に合成されていくように観察されることになる。
DNAポリメラーゼによる合成の開始の際に、一時的に、新生鎖の塩基にプライマー(primer)というRNAの配列が必要である。(※ RNAについては、のちの節で後述する。) プライマーはあとで分解されて、DNAに置き換わる。ラギング鎖では断片がいくつもあるので、結果的にラギング鎖ではプライマーが、伸張時には、いくつも作られることになり、それぞれの断片の最初にプライマーがあることになる。
RNAとアミノ酸合成までのしくみ
[編集]RNA
[編集]

DNAの塩基情報がRNAに写し取られ、そのRNAの情報をもとにタンパク質が合成される。RNAは1本鎖である。 RNAの基本構造は、 塩基+糖+リン酸 からなるヌクレオチドである。 RNAの糖はリボース(英:ribose)である。RNAでは、DNAのアデニン(A)に結びつくのは、RNAのウラシル(U)であり、RNAはT(チミン)を持たない。(ウラシル、英:uracil)
RNAポリメラーゼ(RNA polymerase、RNA合成酵素)という酵素の働きによって転写され、RNAが合成される。このときDNAの領域で、RNAポリメラーゼが結合する領域をプロモーター(promoter)という。
RNAの種類は、働きによって、メッセンジャーRNAとトランスファーRNAとリボソームRNAの3種類に分けられる。
- メッセンジャーRNA
メッセンジャーRNA(mRNA)は、DNAの情報を写し取るためのRNAである。また、真核生物の場合、mRNAはリボソ-ム内へ移動し、そこでトランスファーRNAを正しくならべるための鋳型(いがた)としての役割を持つ。
- トランスファーRNA
-
トランスファーRNA(略称:tRNA)
-
トランスファーRNAの分子モデル
トランスファーRNA(tRNA)は、リボソ-ムまでアミノ酸を運ぶためのRNAである。なので、アミノ酸がトランスファーRNAに結合している。 後述するが、mRNAの塩基3個ぶんの並びによってアミノ酸が決定される。なので、この塩基3つぶんの情報しか、トランスファーRNAは情報をふくまず、タンパク質を構成する多くものアミノ酸の並びについての情報はふくんでいない。
アミノ酸を正しく配列するためには、真核生物の場合、メッセンジャーRNAが必要である。
- リボソ-ムRNA
タンパク質の合成はリボソーム(ribosome)で行われ、トランスファーRNAの運んできたアミノ酸からタンパク質をつくる合成がリボソームで行われる。リボソームのもつRNAは、mRNAとは別の系統であり、DNAにもとづく別系統のRNAをリボソ-ムが持っているので、リボソームRNA(rRNA)という。
真核生物の場合、メッセンジャーRNAが核膜孔から出てきてリボソ-ムへ移動し、トランスファーRNAを正しく並べることで、結果的にアミノ酸を正しく並べる。
このように真核生物では、リボソーム内で、メッセンジャーRNAとトランスファーRNAが再開することになる。
このように、リボソ-ムで合成されるタンパク質でのアミノ酸の並びの決定方法は、おもにメッセンジャーRNAの配列にもとづくのであり、いっぽうリボソームRNAの配列は直接にはアミノ酸の並びの決定には関わっていない。
タンパク質の合成の過程
[編集]まず、DNAの塩基情報を写し取ることで合成されるRNAをメッセンジャーRNA(略記:mRNA)という。 真核生物の場合、核内で、DNAの一部が二本にほどけて、そのうちの一本の情報がRNAに相補塩基として写し取られる。 なお原核生物の場合、そもそも核膜が無いので、原形質の中で同様にDNAがほどけて、RNAに情報が写し取られる。
また、このようにDNAの情報がRNAに写し取られることを転写(てんしゃ、transcription)という。
mRNAの塩基3個の配列が、1つのアミノ酸を指定している。この塩基3個の配列をコドン(codon)という。コドンは、すでに解読されており、この解読結果の表を遺伝暗号表(いでんあんごうひょう)といい、mRNAの配列で定義されている。ほとんどの生物で、遺伝暗号(genetic code)は共通であり、原核生物か真核生物かは問わない。
このように、mRNAの塩基配列にもとづいてアミノ酸が合成される過程を翻訳(ほんやく、translation)という。
塩基3つの組をトリプレットという。DNAの塩基は4種類あるので、トリプレットは4×4×4=64種類ある。天然のアミノ酸は20種類であり、じゅうぶんにトリプレットで指定できる。もし塩基2つでアミノ酸を指定する仕組みだとすると、4×4=16となってしまい、アミノ酸の20種類には不足してしまう。
| 2字目 | |||||
|---|---|---|---|---|---|
| U | C | A | G | ||
| 1字目 | U |
UUU (Phe/F)フェニルアラニン |
UCU (Ser/S)セリン |
UAU (Tyr/Y)チロシン |
UGU (Cys/C)システイン |
| C |
CUU (Leu/L)ロイシン |
CCU (Pro/P)プロリン |
CAU (His/H)ヒスチジン |
CGU (Arg/R)アルギニン |
|
| A |
AUU (Ile/I)イソロイシン |
ACU (Thr/T)スレオニン |
AAU (Asn/N)アスパラギン |
AGU (Ser/S)セリン |
|
| G |
GUU (Val/V)バリン |
GCU (Ala/A)アラニン |
GAU (Asp/D)アスパラギン酸 |
GGU (Gly/G)グリシン |
|
- 脚注
たとえばAUGはメチオニンを指定する。またAUGは翻訳を開始するコドンでもある。 AUGのように、翻訳を開始するコドンを開始コドン(initiation codon)という。
いっぽう、UAA、UAG、UGAは対応するアミノ酸がなく、翻訳を終了させるので終止コドン(termination codon)という。
また、たとえばUUUはフェニルアラニンを指定する。
生物学者のニーレンバーグは1961年、塩基としてウラシル(U)だけを持つRNAをリボソ-ム溶液に加えたところ、フェニルアラニンが大量に合成されたことで、フェニルアラニンの遺伝暗号がUUUであることが発見された。
その後、生物学者コラーナなどのによって、遺伝暗号が解読された。
- セントラルドグマ
遺伝情報は、原則として DNA→RNA→アミノ酸→タンパク質 というふうに一方向に写されていき、その逆方向は無い。この原則をセントラルドグマ(英: central dogma)という。
- ※ 検定教科書でも、この話題はコラム扱い。
セントラルドグマの例外的な存在として、ウイルスによってはRNAを遺伝物質として持つものがいて、このようなウイルスをRNAウイルスという。
- (※ 範囲外 :)ただし、エイズ患者でエイズが子供に遺伝するわけではない。(遺伝情報の)セントラルドグマの例外というのは、あくまでも「ウイルスがRNAを遺伝情報にもつ」などの事を言ってるのであろう。
また、RNAを鋳型としてDNAを合成することを逆転写といい、そのような働きの酵素を逆転写酵素という。 RNAウイルスは、逆転写酵素をもち、逆転写を行う能力をもっている。
エイズの原因であるHIVウイルスもRNAウイルスであり、また、HIVウイルスは逆転写酵素をもっている。
- (※ 範囲外 :)いっぽう、遺伝情報としてDNAをもっているウイルスのことをDNAウイルスという。DNAウイルスにも逆転写酵素をもつウイルスがある。肝炎ウイルスなどは、逆転写酵素をもつ。
なお、ウイルス種類のグループの呼び名として、RNAウイルスであり、さらに逆転写酵素を持っているウイルスのことをレトロウイルスという。
- (※ 範囲外 :)HIVウイルス以外からもレトロウイルスや逆転写酵素は見つかっているが、しかし具体的にどんなウイルスがあるかと言うと、高校の範囲外になって、大学レベルの専門的な話題になるので、説明を省略する。啓発館の検定教科書は、ある白血病ウイルスがレトロウイルスであると具体例を挙げている。他社の多くの検定教科書では、HIVウイルス以外の具体例は説明せず、説明をボカしている。第一学習社の『生物』『生物基礎』教科書に至っては、そもそも、この逆転写のコラムが見つからない。
エイズの治療薬は、この逆転写などを阻害することで、HIVウイルスの増殖を抑えるものである。[1] 現在の科学力ではエイズを完治することはできない。 エイズの治療薬は、逆転写酵素阻害剤、プロテアーゼ(タンパク質分解酵素)阻害剤、インテグラーゼ阻害剤の3種類を組み合わせている。(※高校の範囲内)[2] [3]
なお、現代ではウイルス以外の真核生物からも、RNAの遺伝情報をもとにDNAをつくる酵素が発見されている(※ 東京書籍の検定教科書で報告されている。東京書籍の教科書では、その酵素も「逆転写酵素」と呼んでいる)。
真核生物でのタンパク質合成
[編集]トランスファーRNA
[編集]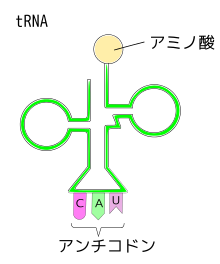

トランスファーRNA(tRNA)は、リボソ-ムまでアミノ酸を運ぶためのRNAである。なので、アミノ酸がトランスファーRNAに結合している。
トランスファーRNAには、mRNAのコドンの3塩基(トリプレット)と相補的に結合する3塩基をもち、トランスファーRNAのその3塩基の部分をアンチコドン(anticodon)という。
トランスファーRNAに、どの種類のアミノ酸が結合するかは、RNAのアンチコドンの配列によって異なる。
一本の、メッセンジャーRNAに対し、トランスファーRNAはいくつも作られる。なぜならトランスファーRNAのアンチコドンは、メッセンジャーRNAのたったの3つぶんの配列にしか相当しないからである。
メッセンジャーRNAの塩基配列をもとに、トランスファーRNAのアンチコドンが決定される。メッセンジャーRNAのコドンとトランスファーRNAのコドンは、お互いに相補的であるので、配列が違うので注意。遺伝暗号表などはメッセンジャーRNAのコドンを基準としており、アンチコドンは基準にしてない。
さて、トランスファーRNAのアミノ酸の種類は、トランスファーRNAのアンチコドンの塩基配列にもとづいており、トランスファーRNAのアンチコドンの塩基配列の決定は、メッセンジャーRNAの塩基配列のコドンにもとづいておるから、最終的に(トランスファーRNAに結合している)アミノ酸の種類の決定はメッセンジャーRNAにもとづく事になる。
リボソ-ムRNA
[編集]タンパク質の合成はリボソーム(ribosome)で行われ、トランスファーRNAの運んできたアミノ酸からタンパク質をつくる合成がリボソームで行われる。リボソームも、独自のRNAを持っているのでリボソームRNA(rRNA)という。
真核生物の場合、メッセンジャーRNA(mRNA)が核から外に出てきて、トランスファーRAN(tRNA)とmRNAがリボソームで出会って、ポリペプチドをつくる。
リボソームに移動したmRNAの塩基配列に、tRNAのアンチコドンが結合する事によって、いくつもあるtRNAの並びが正しく並ぶ。
このようにアミノ酸の配列を決めているのはmRNAであり、けっしてリボソームRNAの配列はアミノ酸の配列決定には関わっていない。 また、リボソームへ移動するRNAは、けっしてトランスファーRNAだけでない。メッセンジャーRNAも、リボソームへと移動している。
さて、リボソ-ムで、tRNAからアミノ酸を切り離す作業が行われる。
そしてリボソームで、アミノ酸をペプチド結合でつなぎ合わせてポリペプチド鎖をつくり、そのポリペプチド鎖が折りたたまれてタンパク質になる。
アミノ酸を切り離されたtRNAは、mRNAからも離れ、tRNAはふたたびアミノ酸を運ぶために再利用される。
このように、リボソ-ムで合成されるタンパク質でのアミノ酸の並びの決定方法は、おもにメッセンジャーRNAの配列にもとづくのであり、いっぽうリボソームRNAの配列は直接にはアミノ酸の並びの決定には関わっていない。
原核生物での翻訳
[編集]mRNAへの転写が行われると、転写の終わりを待たずに、転写中に、ただちにリボソームがmRNAに直接に取りつき、そこでタンパク質の合成が行われる。
スプライシング
[編集]
真核生物では、DNAからRNAへの転写時に、核の中で、いったん全ての配列が転写され、そのあとに配列のいくつが除去されて、残った部分がつなぎあわされてmRNAが出来上がる。

RNAの転写直後の、まだ何も除去されてない状態を mRNA前駆体 という。除去される部分に相当するDNA領域をイントロン(intron)という。mRNA前駆体からイントロンが取り除かれて、残って使われる部分に相当するDNA領域をエキソン(exon)という。エキソンに相当する部分どうしのRNAが繋がる。よってエキソンの領域が、タンパク質のアミノ酸配列を決めることになる。
このようなイントロン除去の過程をスプライシング(splicing)という。スプライシングは核の中で起きる。
mRNAは、転写直後のRNAから、こうしてイントロンに相当する配列が除去されてエキソンに相当する配列どうしが繋がった物である。
スプライシングが完了してmRNAになってから、mRNAは核膜孔を通って核の外へと出て行き、リボソームでのタンパク質合成に協力をする。
- 選択的スプライシング

ある遺伝子の配列から、2種類以上のmRNAが作られる場合がある。これは、mRNA前駆体は共通だが、スプライシングの過程で、エキソン対応領域が除去される場合もあり、どのエキソンを除去するかの違いによって、最終的に出来上がるmRNAが変わってくるからである。また、いくつかのイントロン対応領域が除去されずに残る場合もある。エキソンどうしが繋がるときに、となりどうしのエキソンではなく、離れたエキソンと繋がる場合もある。
こうして、数種類のmRNAが作られる。これを選択的スプライシング(alternative splicing)という。
こうして少数の遺伝子から、選択的スプライシングによって多種類のmRNAが作られ、多種類のアミノ酸配列が出来て、多種類のタンパク質が作られる。
- 原核生物の場合
原核生物の場合は、一般に、転写で出来た配列が、そのままmRNAになる。よって原核生物ではスプライシングは起こらず、したがってイントロンを原核生物は持たない場合が普通である。
センス鎖
[編集]2本鎖のうち、転写されるのは、どちらか片方である。残りのもう片方の鎖は転写されない。 どちらの鎖が転写されるかは、場合によって変わり、けっして、あらかじめは決まってない。 転写されないほうの鎖をセンス鎖(センスさ、sense strand)という。転写されたほうの鎖をアンチセンス鎖(アンチセンスさ、sense strand)という。
どちらがセンス鎖になるかは、けっして、あらかじめは決まってない。
発展: RNA干渉
[編集]- (※ どの検定教科書や参考書にも書いてある話題だが、まだ1998年に発見されてから年月が二十数年ほどしか経ってないので(※ 2020年に本文を確認)、よって未解明などの部分も多く、参考書でも発展項目として扱われている。)
- ※ 自然科学の業界では、10年~30年前なんて、ごく最近という扱いである。特に高校教育では、背景事情などを明確に解明しつくしてから若者に教育する必要があるので、そういう比較的に新しい話題は、コラム扱いなどになる。
- RNA干渉
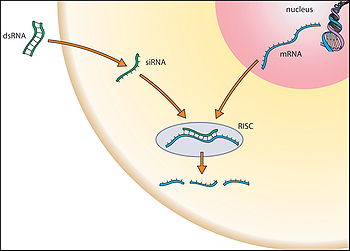
ダイサーといわれる酵素で二本鎖RNAを分解する。
切断されたRNAがタンパク質を結合し、RISCといわれる複合体を形成する。
このRISCが、翻訳などの妨害をする。
- 前書き
ある生物の細胞内に、もし外部からウイルスが侵入した場合、その細胞はすでにウイルスに感染されてしまってるので、生物はウイルスの増殖を防ぐ必要があり、ウイルスに感染した細胞の増殖やさまざまな活動を止めなければならないだろう。
上記のような理由だろうか、下記のような実験事実がある。
- 実験事実など
まず、真核生物では、RNAには、翻訳を行わない種類のものや、翻訳を妨害するものがあることが、わかっている。
真核生物でのmRNAの転写後に、もし、細胞内などに、そのRNAとは他のある短いRNAが存在している場合、そのある短いRNAがmRNAに結合して、mRNAを分解したり、リボソ-ムの翻訳を妨げたりするなどして、mRNAに(たいていは妨害的に)関わることをRNA干渉(RNA interference、略称:RNA i)という。
このような反応によって、mRNAの発現が妨げられる。このときの短いほうのRNAの長さは、切断され、塩基対の数が21塩基ほどになる。(参考文献: 羊土社『理系総合のための生命科学』、著: 東京大学生命科学教科書編集委員会、2007年第1刷、120ページ、コラム内の記事)
または細胞の遺伝子組み換えの際に、短いRNAを目的の細胞に人工的に導入して、上記のような切断反応や妨害反応などによる、遺伝子の発現の妨害(ノックダウン)を起こさせる事にも利用される。
RNA干渉は、外部から侵入したウイルスなどのRNAも切断したりもする。 歴史的な経緯によりセンチュウに存在するRNA干渉が有名だが、しかし、センチュウのほかにも、多くの菌類や植物などにもRNA干渉の現象は存在する(※ 第一学習社の検定教科書:)。
このため、外部の病原体や異物などの分解の仕組みとして、RNA干渉が発達してきたのだろうと考える研究者もいる。(参考文献: 裳華房『理工系のための生物学』、坂本順司、2015年8月10日 改訂版、133ページ、傍注、)
RNA干渉の発見者はファイアーとメローであり、センチュウを用いた実験で1998年に発見された。ファイアーらはノーベル生理学・医学賞を2006年に受賞した。
医療応用などにも期待されており、RNAの制御を通してDNAの発現を制御できそうだという期待をされている。
RNAを導入するときに、相補的なRNAどうしを結合させて二本鎖RNAにした場合のほうがRNA干渉が発現しやすい。書籍によっては、RNA干渉の紹介のときに最初から、「細胞に、ある短い二本鎖RNAを導入すると、mRNAを切断したりリボソームの結合を阻害したりして発現を阻害することをRNA干渉(略称:RNA i)という。」などというように、二本鎖RNAであることを前提としてRNA干渉を紹介している場合もある。
- RNA干渉の仕組み (高校の範囲。啓林館や数研出版などの教科書に記述あり)
- ダイサーといわれる酵素で2本鎖RNAを切断して、短い2本鎖RNAにする。
- ↓
- さらにそのRNAが、1本鎖に分解される。
- ↓
- その1本鎖RNAがタンパク質と結合して、複合体(RISCと言われる)を形成する。さらに、相補的な配列をもつmRNAと結合する。
- ↓
- こうして出来上がった複合体が、mRNAを分解したり、リボソームによる翻訳を妨害したりする。
(※ 範囲外) よく、セントラルドグマの例外的な現象として、エイズなどの逆転写が上げられるが、逆転写以外のセントラルドグマの例外として、RNA干渉もセントラルドグマの例外とみなせる。(※ 参考文献: たとえば 東京大学理学系研究科-理学のキーワード-『RNA干渉』 2018年10月21日に閲覧)
- 読者への注意
※ じつは、本wikibooksの本章にあるような、前書きでの免疫的な説明による仮説は、検定教科書には無い(ただし、第一学習社だけ(「免疫」ではなく)「生体防御」という語で、後書きしており、センチュウなどからの防御と説明している)。検定教科書では、先入観を除去するためだろうか、免疫的な内容を、説明の前置きにはしていない。しかし、本wikibooksでは、まずRNA干渉の動作過程を学生に覚えやすくするため、便宜的に、免疫的な内容を前置きした。
大学レベルの教科書でも、免疫的な説明の前置きは無く、免疫的な内容は、あとがき的に、仮説のひとつとして説明されている場合が多い。
突然変異
[編集]かま状赤血球貧血
[編集]
かま状赤血球貧血(sickle-cell anemia)は、欠陥をつまらせる。溶血して貧血の原因にもなる。
原因は、ヘモグロビンをつくるアミノ酸配列の異常であり、その配列異常の原因は、DNA配列の異常。 そもそもヘモグロビンはタンパク質で、できている。 ヘモグロビンタンパク質の6番目をつくる遺伝子のDNA配列上のある一個のチミンが、アデニンに置き換わっているため、この病気が起きる。 この置き換えによって、本来ならmRNAのコドンのGAGという配列によってグルタミン酸(Glu)というアミノ酸が出来るべきところが、GUGというコドンになってしまっているのでバリン(Val)というアミノ酸が出来る。 このためヘモグロビンのアミノ酸配列が変化し、結果的にヘモグロビンタンパク質の立体構造が変化して、かま状の構造になる。
鎌状赤血球貧血症の患者はマラリアに強く、そのためマラリアの生存地域のアフリカなどでは、むしろ生存に有利でもある。 マラリアの起こる仕組みは、マラリア原虫が赤血球に感染して起きる病気である。
パフ
[編集]ショウジョウバエやユスリカの幼虫の唾腺(だせん)の細胞では、巨大な染色体が観察でき、その唾腺(だせん)染色体では、パフという、膨らんだ部分のある染色体が観察される。パフでは転写が活発に行われている。パフの位置は、発生の成長の段階に合わせて、パフの位置も変わっていく。 このようなことから、遺伝子は、けっして常に同時に転写されるわけではなく、そうではなくて、発生にともなって活発化する遺伝子が変わっていくことが分かる。
昆虫の脱皮やさなぎ化などの変態はエグジステロイドというホルモンによって促進される。パフの発現も、エグジステロイドによって促進されている。
遺伝性の代謝異常
[編集]ヒトの必須アミノ酸でフェニルアラニンというアミノ酸がある。 健康な人間なら、不要になったフェニルアラニンは分解される。しかし、フェニルケトン尿症(phenylketonuria)の患者では、そうではない。 この病気は遺伝病であり、原因は遺伝子の配列にある。
フェニルケトン尿症では、フェニルアラニンをチロシンに変換する酵素の遺伝子の塩基が変化してしまっていることが原因であり、そのため変換酵素が合成できず、その結果、チロシンが合成されないで、ファニルアラニンが血液中に余り、フェニルケトンに変化して、尿中にフェニルケトンとして排出される。

※ 黄色は物質名、赤枠内は症状名。
チロシンをもとにして、メラニン(melanin)やアルカプトンなどが合成される。
メラニンを合成する酵素に異常が起きた遺伝性の症状が、アルビノ(albinism)である。
アルカプトン(ホモゲンチジン酸)は、健康なヒトでは最終的に分解され、水と二酸化炭素になる。を分解する酵素(ホモゲンチジン酸オキシダーゼ homogentisate dioxygenase)に異常が起きたため、この酵素が無く、アルカプトンを分解できなくなった遺伝病がアルカプトン尿症(alcaptonuria)である。アルカプトン尿症では、尿中に尿を放置すると、尿が黒くなる。

- ※ (範囲外?) (他科目の知識: ) ケトンについては、『高等学校化学I/脂肪族化合物/ケトン』を参照せよ。
- (範囲外 ) フェニルケトン尿症は、神経症状を起こすため、乳幼児には知的発育障害をもたらす。フェニルアラニンを含まない食事療法が必要である。(※ 詳細は省略。)
なお「アルビノ」とは、メラニン色素をつくる遺伝子が突然変異などで欠損したことによって起こり、そのために、体が全体的に白く、瞳(ひとみ)は赤い、症例または そのような動物個体。わかりやすい例でいうと、白ウサギのような色をしている動物がアルビノである。なお、アルビノ者の瞳の赤色は、毛細血管の色である。
DNA修復
[編集]
紫外線により、DNA上で隣接する2個のチミンどうしに紫外線が当たれば、チミンどうしが結合してしまい、こうしてチミンは損傷する。
こうした損傷を受けると、損傷を直すために、二本鎖のうちの損傷を受けた側のヌクレオチドとその周囲の塩基(除去される塩基数は十数ほど)が除去されて、新しい塩基と置き換わる。
DNAポリメラーゼによって、損傷を受けてない側の鎖の塩基をもとに、相補的な配列が加えられ、DNAリガーゼで両端がつながれることで、修復される。
- (※ 範囲外: )このような研究の歴史は意外と古く、1962年にストロウ夫妻がインフルエンザ菌(インフルエンザウイルスとは別物)に紫外線を照射する実験や、1964年にストロウとキャリア(人名、 Carrier,w.L.)が大腸菌にUV(紫外線)を照射する実験などにより[4]、チミン二量体が出来ることが遺伝子障害の原因である事までなら1960年代には既に解明されていた。
遺伝子の発現調節
[編集]大腸菌のラクトース分解
[編集]
1:RNAポリメラーゼ、2:lac リプレッサー、3:プロモーター、4:オペレーター、5:ラクトース、6: lacZ、7: lacY、8: lacA.
大腸菌は、生育にグルコースを必要とする。では、乳糖(ラクトース)などの、他の糖では、どうなるか。
フランスのジャコブとモノーの1965年ごろの実験により、大腸菌とラクトース(乳糖)について、以下の事が明らかになった。
大腸菌はグルコースがある環境では、ラクトース(乳糖)を消化しない。しかし、グルコースが無くて、ラクトースがある環境では、ラクトースを分解する酵素(βガラクトシダーゼなど)を合成し、大腸菌はラクトースを消化する。
また、突然変異をした大腸菌では、グルコースがあってもラクトースを分解する株も、あらわれた。
この突然変異の事から、遺伝子が、関わっていることが予想される。
また、突然変異でない通常の株について、糖の分解では酵素が働いてるわけであるが、そもそも酵素の合成には遺伝子が発現をしているわけだから、つまり遺伝子の発現の何かが環境によって変わったことになる。通常の株については、グルコースが多かろうが少なかろうが、DNAの塩基配列そのものは同じであり、DNAの塩基配列は何も変わっていない。グルコースの多いか少ないかで変わったのは、DNAの発現の何かである。
では、具体的に、いったい、DNAから酵素合成までのどの段階で、発現の有無を切り替えているのだろうか、という疑問が、本節で説明することである。
つまり、もしやDNAが発現しないことでRNAが存在してないのか、それともRNAが発現しないことでポリペプチドが存在していないのか、あるいはポリペプチドが発現していないことで酵素として発現していないのか、それとも・・・、などの検討である。
大腸菌のラクトース分解の場合は、DNAに調節タンパク質がくっつく事によって、DNAの発現の調節が起きていることが分かっている。このような調節タンパク質がくっつくDNAの領域をオペレーター(operator)といい、その遺伝子群をオペロン(operon)という。
(※ 以下、参考文献:Wikipedia日本語版記事『オペロン』)
この大腸菌のラクトース分解の機構は、1980年ごろからの遺伝子工学やX線構造解析などの実験などによって、近年になって機構が証明された。1960年代の当事では、まだ仮説であり証明できておらず、おそらくDNAの段階で調節されているのだろうという仮説の段階であった。
(Wikipedia解説おわり)
ジャコブとモノーは、おそらくDNAの段階で調節されているのだろう、というオペロンの機構の説を提唱し、これをオペロン説(operon theory)という。
RNAポリメラーゼは、DNAからmRNAへの転写の開始の際、まずプロモーターというDNA領域に、くっつく。 大腸菌のラクトース分解の事例では、大腸菌DNAのプロモーターと、酵素の遺伝子との間に、オペレーターがあって、このオペレーターに調節タンパク質がつくことで、mRNAへの転写を中断させるという仕組みで、発現を抑制してるのである。
そして調節タンパク質がDNAに結合できるかどうかが、環境中の物質によって変わってくることになる。
さて、転写を抑制する調節タンパク質のことをリプレッサー(repressor)という。
大腸菌の場合、グルコースが多い通常時は、ラクトース分解酵素の遺伝子DNAの直前の領域について、リプレッサーとして働く調節タンパク質が、オペレータ領域に結合することでRNAポリメラーゼの進展を妨害し、こうしてラクトース分解酵素の発現を抑制している。
またラクトースがありグルコースが無い環境では、大腸菌は、リプレッサーとして働く調節タンパク質の形状が変わり、もはや調節タンパク質はオペレータ領域に結合できなくなる。すると、グルコースが多い通常時ではRNAポリメラーゼの進展を妨害していた結合タンパク質がなくなるので、RNAポリメラーゼが酵素遺伝子に向かって進展ででるようになり、こうして酵素の遺伝子をRNAポリメラーゼが転写して、ラクトース分解酵素が発現する。
なお、大腸菌のラクトース分解の以外の事例では、別にRNAやタンパク質などが酵素の発現を調節する事が無いわけではない。そのような現象もある。単に大腸菌のラクトース分解の場合では、DNAにリプレッサーが結合することで、酵素の発現を調節しているということである。
これらの結果から、また、調節タンパク質をつくるための遺伝子も存在している事が分かる。
調節タンパク質をつくるための遺伝子を調節遺伝子(regulatory gene)という。
トリプトファン
[編集]大腸菌では、アミノ酸のトリプトファンが多いとき、転写が促進される 。トリプトファンが少ないとき、転写が抑制される。
真核生物と転写調節
[編集]ヒストン
[編集]- (図をここに)
真核生物のDNAは、通常時は、ヒストン(histone)という球体のタンパク質に、まとわりついている。このヒストンは、ヒストン4個(つまり球体4個)で、一つの組になっている。ヒストンにDNAがまとわりついた構造をヌクレオソーム(nucleosome)という。さらに、このヌクレオソームが連なったものが、折りたたまれる構造をとっており、このヌクレオソームの折りたたまれた構造をクロマチン繊維(chromatin fiber)という。
DNAからRNAへの転写について、このようなヌクレオソームな状態では(つまり、ヒストンにDNAが、まとわりついた状態ではクロマチン繊維がぎゅうぎゅうにくっついているため、RNAポリメラーゼがくっつくことができない)、転写できない。転写の前にヒストンから、DNAが、ほどかれる必要がある。
ヒストンの特定のアミノ酸にアセチル基 -CH3CO- が結合することで、DNAとヒストンとの結合が弱くなり、ヒストンからDNAが、ほどかれる。
いっぽう、ヒストンの特定のアミノ酸にメチル基が結合すると、ヒストンに強く結合するので、ほどけにくくなるため、転写されにくくなる。
ホルモンと遺伝子発現
[編集](※ 未記述)
突然変異
[編集]- 異数体
染色体は、ふつうは2nだが、まれに2n±1や2n±2などの個体が現れ、このような性質を異数性といい、その性質を持って生まれた個体を異数体という。
- 倍数体
染色体の核相が3nや4nの場合、そのような性質や現象を倍数性といい、その性質を持って生まれた個体を倍数体(ばいすうたい、ploid)という。3nのものを三倍体といい、4nのものを四倍体という。なお、通常の核相2nの個体を二倍体という。
三倍体は正常には減数分裂ができないため、生殖能力が無い。たねなしスイカは三倍体であるので、種を持たないのである。
4nなどの倍数体は、化学薬品のコルヒチンなどで生じやすい。なお、コルヒチンそのものはユリ科のイヌサフランなどに含まれる。 細胞分裂時の紡錘体の形成を、コルヒチンが阻害する。このため、細胞分裂時に倍増した染色体が両極に分かれず、そのまま四倍体の細胞になる。
三倍体は、四倍体と二倍体とを交配させて作る。
- 突然変異の種類
- 欠失 ・・・ 染色体の一部が切れて消失。
- 重複 ・・・ 染色体の一部が繰り返す。
- 転座 ・・・ 染色体の一部が切り離され、その離れていった部分が、ほかの染色体の一部として結合する。
- 逆位 ・・・ 染色体の一部がいったん切り離されて、結合しなおすときに、逆向きになって結合した場合、結果的に逆向きの配列になる。
- 人為突然変異の方法
- 物理的現象による誘発・・・ 放射線やX線、紫外線
- 化学的現象による誘発・・・ マスタードガス、亜硝酸
- パンコムギの遺伝子について
(※ 未記述)
- (他単元の知識)
「アルビノ」とは、メラニン色素をつくる遺伝子が突然変異などで欠損したことによって起こり、そのために、体が全体的に白く、瞳(ひとみ)は赤い、症例または そのような動物個体。わかりやすい例でいうと、白ウサギのような色をしている動物がアルビノである。なお、アルビノ者の瞳の赤色は、毛細血管の色である。
フェニルケトン尿症やアルカプトン尿症については、他の単元で説明する。(単元「遺伝性の代謝異常」など。)
- ダウン症候群(Down's diseasef) (※ 高校教科書の範囲外.)
- ※ 数研出版チャート式で90年代から2010年代まで、ずっと記載されている。いっぽう、文英堂シグマベストには記述が無し。
ダウン症候群とは、ヒトの遺伝病の一つであり、21番目の染色体が一本多い。先天的な知能障害がある(※ 参考文献: 『チャート式新生物 生物基礎・生物』平成26年版)。このため染色体数は合計で47本になる。母親の高齢出産で生じやすい。
(※ 理科の範囲外 :)なお、人間の場合、高齢出産でダウン症が起きる確率が上がる。(※ 清水書院の社会科の資料集『現代社会ライブラリーへようこそ 2018-19』でも紹介。)
近年、出生前診断(しゅっせいまえ しんだん)により、胎児のダウン症や流産などの異常の有無を検査できるようになった(※ 2019年に記述)。
執筆予定
[編集]- マラー
- キイロショウジョウバエの雄にX線
- 突然変異
- 大腸菌の光吸収
- 連鎖
- 組み換え
- 検定交雑
バイオテクノロジー
[編集]おもに遺伝子工学について、この単元では解説される。
制限酵素
[編集]たとえば大腸菌は、菌体内に侵入してきたウイルスのDNAを切って殺す酵素を持つことがわかっている。この酵素は、特定の配列をもつDNAの特定の箇所を切断することがわかった。制限酵素にDNAを混ぜると、DNAの特定の配列を切断する。 大腸菌の持つEcoR1(エコアールワン)は GAATTC という配列を持つDNAをその個所で、GとAの間を切断する。

というふうに、切断する。
ほかのバクテリアなどからは、BamH1(バムエイチワン)が発見された。 BamH1は、GGATCCを切断する( G(切)GATCC )。 このように酵素が異なれば、切断する配列も異なる。
これらのような、特定の配列のDNAを切断する核酸分解酵素を制限酵素(せいげんこうそ、restriction enzyme)という。

いっぽう、切れたDNAをつなげるDNAリガーゼ(DNA ligase)という酵素も見つかっている。 制限酵素とDNAリガーゼは、DNAを組替えるための、ハサミとノリのような物として利用できる。制限酵素がハサミであり、DNAリガーゼがノリである。 このような酵素をいくつも用意しておけば、人間が酵素を混ぜることによって、遺伝子の組換えができる。 二本鎖DNAでは、A-T、G-Cがついになっている。 EcoR1の切断する、GAATTCの対は、
- GAATTC
- CTTAAG
というふうに、下側のDNA配列(CTTAAG)を逆向きに読むと、上の配列と同じになっており、回文(かいぶん)構造である。回文とは、「たけやぶ やけた」とか「しんぶんし」とかのような逆さ読みしても同じ言葉になる文のことである。
なお、遺伝子組み換えした生物のことをトランスジェニック生物(トランスジェニックせいぶつ)という。
遺伝子の組み込み方法
[編集]- プラスミド

2本鎖DNAの両端がつながり、環状になっているDNAをプラスミド(plasmid)という。大腸菌にはプラスミドがある。遺伝子の組換えではプラスミドが、用いられる場合が多い。プラスミドは菌体内で独立して増える。バイオテクノロジーでの遺伝子組み換えのときに、大腸菌などのプラスミドに遺伝子を組み込んで、その菌に取り込ませて菌のDNAに組み込む事が多い。DNA発現時に有用なタンパク質を生産するDNAを組み込めば、遺伝子組み換えした菌を増殖させることで、その菌に有用なタンパク質などを作らせたりもできる。 遺伝子組み換えのときのプラスミドのように、遺伝子組み換えのときに目的の生物に遺伝子を組み込むための容れ物のことをベクター(vector)という。vectorとは「運び屋」という意味である。
ヒトの糖尿病の治療に用いられるインスリン(すい臓のホルモン)や、ヒトの成長ホルモンも、遺伝子組み換えした大腸菌で、すでに生産できるようになった。このように天然からは少量しか採取できないタンパク質や酵素などを遺伝子組み替え技術を用いて大量生産する技術が研究・開発されている。
大腸菌はプラスミドを持ち、プラスミドの中に、大腸菌自身が作る制限酵素をコントロールする遺伝子を持つ。 たとえば輪ゴムを切ると一本のゴム糸になるように、プラスミドは制限酵素を用いて切断されると、切断されたプラスミドは線状になる。
- アグロバクテリウム
植物に遺伝子を組み込む場合は、アグロバクテリウム (Agrobacterium)という土壌細菌と、そのプラスミドを用いる場合が多い。アグロバクテリウムを植物に感染させて遺伝子を組み込む。
目的の遺伝子をプラスミド中に組み込み、そしてアグロバクテリウムを植物に感染させる方法で、植物に組み込む。
なお、このように、遺伝子組み換えした植物のことをトランスジェニック植物という。
植物によってはアグロバクテリウムが感染しづらい場合もある。そのような感染しづらい場合、後述の細胞融合などの方法を用いたり、微小ピペットなどで直接的に導入する場合もある。
- 形質転換
遺伝子組み換えなどによって、個体の形質を変えることを、形質転換(けいしつ てんかん)という。
- その他
研究中の遺伝子組み換え生物では、その安全性が、まだ検証中の場合もあり、なので実験中の生物が外部に漏れないようにするなどの対策も行う必要もある。
- カルシウムによる大腸菌へのプラスミド組み込み
カルシウムイオンCa2+は大腸菌の細胞膜の透過性を上げるので、カルシウムイオンを発生させる物質を加えると大腸菌がプラスミドを取り込みやすくなる。このカルシウムイオンによる大腸菌へのプラスミド組み込みの実験では、塩化カルシウム Cacl2 がよく使用される。このようにして大腸菌にプラスミドを取り込ませて形質転換を起こさせる。
ポリメラーゼ連鎖反応
[編集]- 原理
DNAは95℃程度の高温にすると、塩基間の水素結合が外れて、一本鎖に分かれる。この現象を利用して、さらにDNA合成酵素のDNAポリメラーゼ(DNA polymerase)と、材料の塩基対4種類(アデニン・チミン・グアニン・シトシン)を使って、DNAの個数を2倍に複製する事が出来る。
95℃で2本に分かれた一本鎖の両方ともDNAポリメラーゼで相補塩基を足されて2本鎖になるから、最終的にDNAの個数が2倍になる。
同じ反応を何回も繰り返すことで、最初から数えて 2倍→4倍→8倍・・・ と倍倍でDNAの個数を複製できる。
増幅率は、理論上は20回くりかえすと、220=1048576個になる。
DNAポリメラーゼは、すべての生物にあるが、この反応で用いるDNAポリメラーゼは温泉などから発見された細菌に由来する、熱に強い耐熱性のDNAポリメラーゼを用いている。
このようなDNAポリメラーゼを用いたDNAの複製技術をPCR法(ピーシーアール法)あるいはポリメラーゼ連鎖反応(polymerase chain reaction)という。
DNAポリメラーゼによる合成の開始には、出発点としての塩基対の一本鎖が別に必要である。あらかじめ化学合成しておいた短めの相補塩基対の一本鎖をプライマーという。プライマーが合成の出発点として必要である。
- 手順
くわしい手順は、次の通り。
- 92℃~95℃程度に加熱。
- 55℃程度に下げて、プライマーの結合を行う。
- 約72℃で、DNAポリメラーゼを働かせる。こうして材料のA、T、G、Cを消費して、二本鎖DNAが複製される。
- 以上の作業をくりかえす。
増幅率は、理論上は「20回くりかえすと、220=1048576個になる」だが、実際には、一回の工程では、かならずしも複製しきれないこともあり、理論値よりも実際の増幅率が低くなる。
電気泳動
[編集]
- (でんきえいどう、electrophoresis)
まず、DNAは、水の中では負の電荷を帯びる。なぜなら、DNAのリン酸基が電離するためである。よって、適切な緩衝液の中ではDNAは負に帯電している。このような緩衝液の水溶液で湿らした寒天ゲルの中にDNA断片を置く。寒天の材質にはアガロースが良く用いられる。 さて、DNA断片に電場をかけると+極に引かれて動き出す。


このとき、移動速度は、長いDNA断片ほど、寒天の網目に引っかかるので移動速度が遅い。
このような実験を電気泳動(でんき えいどう、electrophoresis)という。電気泳動によって、移動速度を実験的に調べることで、DNAの長さを実験的に調べられる。つまり、DNA断片の分子量や塩基数を実験的に調べられる。
実験の際、比較のため、長さを調べたいDNA断片とは別に、すでに塩基数・分子量が分かっている別のDNA断片も用いて比較実験する。このような比較のための既に塩基数や分子量の分かっているDNA断片をマーカーという。
観測する際は、泳動後にDNA染色液を用いて染色する。実験装置の構造上、DNAが帯(バンド)状に染めだされるので、DNA電気泳動で染めだされた物をバンドという。このバンドの位置から、塩基数を推定する。
- DNA鑑定
まず人によってDNAの配列は微妙に違っている。制限酵素でDNAを切ると、得られるDNAの断片の長さは人によって違う。このDNA断片を電気泳動にかけると、人によって、DNA断片の移動速度が違う。
刑事捜査や血液鑑定などに応用されている。
緑色蛍光タンパク質
[編集]オワンクラゲは緑色に光る蛍光タンパク質を持つ。このオワンクラゲの緑色蛍光タンパク質のことをGFP(green fluorecent protein)という。このGFPが、遺伝子組み換え実験での、組み込んだ遺伝子の発現を調べるための目印として、よく用いられる。
まず、GFPに紫外線を与えると、緑色の蛍光を発する。
調べたいDNA配列の一部に、オワンクラゲの緑色蛍光タンパク質(GFP)の遺伝子を組み込む。すると、調べたいDNA配列が発現している箇所で、いっしょにGFPの遺伝子も発現し、その結果、緑色の蛍光を発する。調べたい対象の生物を生きたまま蛍光させられるので、生きたまま遺伝子の発現を調べることができる。
下村修(しもむら おさむ)が2008年に、オワンクラゲのGFPの研究でノーベル賞を受賞した。
なお、ホタルの発光は、これとは異なる仕組みであり、ホタルの光は化学反応による発光でありATPを消費する。
- (範囲外: )イクオリン
- ※ チャート式にイクオリンの存在は書いてあるが、カルシウムの検出用途については書かれてない。
実は、オワンクラゲの体内では、光のおおもとの光源はGFPではない。イクオリン (aequorin) というタンパク質が、オワンクラゲの発光の光源である。イクオリンにカルシウムが結合すると、青く光る。(このため研究ではイクオリンは細胞中のカルシウムの検出にも用いられる。)
目的の細胞への注射、または組み換え遺伝子により、目的の細胞の部位にイクオリンを含ませるのである。) (※ イクオリンの導入方法が注射の場合もあることについての参考文献: 羊土社『基礎から学ぶ生物学・細胞生物学』和田勝、2015年第3版、194ページ、)
イクオリンからの青色の光をGFPが受け取り、緑色に変換しているのである。
このイクオリンを発見した人こそ、ノーベル賞受賞をした下村修(しもむら おさむ) である。
なお、単にGFPで緑色に光らせたい目的の実験なら、イクオリンが無くても紫外線を照射すれば、GFPが緑色に発光する。(※ 参考文献: チャート式の生物、平成26年4月版)
トランスジェニック作物
[編集]サンガー法
[編集]DNAポリメラーゼを用いたDNAの複製時に、材料のヌクレオチドに、塩基配列中のデオキシリボースの代わりにジデオキシリボースを持つ特殊なヌクレオチド(つまりジデオキシヌクレオチド)を作っておくと、そのジデオキシリボースがDNAに混ざったところで合成が止まる。
これを利用して、塩基配列を解析する方法が、ジデオキシ法(あるいはサンガー法ともいう)である。
まず、解析したいDNAを一本鎖にする。 そしてジデオキシリボースの塩基ごと(A、T、G、C、)に、合計4色の異なった蛍光色素で標識する。 あとはDNAポリメラーゼで合成を開始させればよい。
たとえばA(アデニン)にジデオキシリボースwp持つ物をある蛍光色素(1とする)で染色し、Tに持つ物を色素2で染色し、Gに持つ物を蛍光色素3で染色、Cに持つ物を蛍光色素4で染色する。このように、それぞれを異なる色素で染色しておく。こうすれば、合成が止まったときのDNAの蛍光色素の色で、止まった部位の塩基が分かる。
これと電気泳動を組み合わせれば、長さごとに分けられるので、あとは長さの順に並べて塩基を読めば、DNAの配列が分かる。
細胞融合
[編集]植物や菌の細胞を、まずペクチン質が細胞どうしをくっつけているので、ペクチナーゼで、そのペクチン質を溶かす。そしてセルラーゼで細胞壁を溶かす。(またはリン酸カルシウムを用いて、細胞壁を溶かす場合もある。)
なお、実際の実験では、浸透圧を調節する必要がある、浸透で細胞を壊さないようにするためセルラーゼ液などにマンニト-ルやグリシンなども加えている。[5]
細胞壁がなくなると、細胞融合が起こりやすくなる。細胞壁がなくなると、内側の球形の細胞だけが残る。この細胞壁の無くなった残りの内側の球形の細胞をプロトプラスト (protoplast) という。プロトプラストは細胞膜だけに包まれている。プロトプラストと組換えプラスミドを混合すれば、細胞融合が行われる。細胞壁が残ったままだと、融合はほとんど行われない。
融合を開始するにはポリエチレングリコール(PEG)を加えるか、あるいはセンダイウイルス(HVJ)を用いる。センダイウイルスは動物細胞の融合でも利用される。
- ポマト(=ポテト+トマト)、オレタチ(=オレンジ+カラタチ)
このような細胞融合の方法で、ポマトとトマトの細胞を融合したポマトも開発された。しかし、特性などが悪く、たとえばジャガイモの芽にある毒がポマトにも含まれるなどの短所もあり、実用化されなかった。
- Tプラスミドをほかの細胞に挿入する方法 (参考)
- 1 あらかじめ、制限酵素を用いて、組換えプラスミドを作る。
- 2 セルラーゼで侵入される細胞の細胞壁を破壊する。
- 3 組換えプラスミドの入った細胞を培養する。
- 4 遺伝子組み替え細胞に限らず、一般の植物細胞でも、細胞を培養すると細胞の かたまり( カルス(callus) )になるになる。
- 5 カルスを育て続けると、完全な植物体の全体を再生できる。
その他の応用
[編集]- 発展: ルシフェラーゼ (※ 『科学と人間生活』(啓林館、第一学習社)で、概要が紹介された)
ホタルの尻尾にある発行物質ルシフェリンは、ルシフェラーゼを酵素として、アデノシン3リン酸ATPと酸素O2と反応して、オキシルシフェリンという、ルシフェリンに酸素の化合した物質を生成する。この反応に伴って、発光が起こる。
- ルシフェリン + ATP → オキシルシフェリン + 光
- (触媒:ルシフェラーゼ)
よって、ルシフェリンと蛍光光度計を用いることにより、ATPの量が測定できる。
反応する前のルシフェリンとルシフェラーゼの量を、一定にしておけば、ATPの量によって発光の強さが変わるからである。
ところで、ほとんどの細菌は体内にATPをもつから、ルシフェリンを用いて、細菌の量を測定できる。つまり、微生物による汚染の度合いを測定できる。
実用品として、すでに食品やレストランの衛生の度合いを測定するためのキットとして、ルシフェリンを含んだキットが実用化している。
(※ 以降、範囲外?)
ルシフェリンを用いた微生物量の測定
- 原理は次のようになる。
- 1 試験管を用意して水を入れておく。
- 2 ルシフェリンとルシフェラーゼの混合溶液を用意しておく。
- 3 細菌の量を測定したい検査対象を綿棒でふき取る。
- 4 綿棒の先を水に入れる。
- 5 水に油を混ぜて菌を破壊して、ATPを菌体外に出す。
- 6 試験管内の水にルシフェリンとルシフェラーゼの混合溶液を1滴だけ混ぜる。
- 7 試験管内の溶液が光る。
- 8 光度を、蛍光光度計で測定する。
しかし細菌の体内にあるATPはこのままでは、ルシフェリンの混合液とは反応しない。細菌の細胞壁を破壊して、菌体外にATPを出してからでないと、ルシフェリンとは反応しない。よって、水に油を混ぜて菌を破壊して、ATPを菌体外に出す必要がある。
従来の方法では、検査対象をガーゼでふき取り、付着した微生物を寒天培地で一晩ほど培養し、バクテリアのコロニーを数えていたので、検査に1日かかっていた。 だが、ルシフェリンを用いた方法では短時間で終わる。 この方法には、大量のルシフェラーゼが必要になる。ホタルは希少な昆虫であり、乱獲するわけには行かないので、ホタル以外からの生産方法が必要になる。 日本の民間企業であるキッコーマン株式会社は遺伝子工学を用いてルシフェラーゼを大量生産することに成功した。大腸菌にルシフェラーゼを作る遺伝子を導入して、大腸菌にルシフェラーゼを生産させる方法である。
ルシフェラーゼの生産
- 原理
- 1 ゲンジボタルの尻にある発光器の中にある細胞から、ルシフェラーゼを作るmRNAを取り出す。
- 2 これに逆転写酵素を加えて2本鎖のcDNAを作りプラスミドに入れる。
- 3 さらに組替えプラスミドを大腸菌に挿入する。
- 4 組替え大腸菌を培養することにより、ルシフェラーゼを大量生産できる。
組織培養
[編集]植物細胞の培養
[編集]
植物の細胞片に植物ホルモンや培養液などを与えると、それから未分化の細胞の塊(かたまり)を育成したり、さらには個体を育成できる。こうしてできた未分化の細胞塊(さいぼうかい)をカルス(callus)という。
培養する前の細胞片は、植物の分化した細胞だったわけだから、その培養細胞から個体が作れたということは、再び分化したことになる。このような植物は条件を整えれば再度の分化をすることを再分化(さいぶんか)という。また、植物の細胞片から培養などで個体を作れることを分化全能性(ぶんかぜんのうせい)あるいは単に全能性という。 このように、分化した細胞片が全能性のある細胞に戻ることを脱分化(だつぶんか)という。
ちなみに細胞壁を除去した植物細胞であるプロトプラストを培養すると、細胞壁を再生する。
カルスを培養する際、添加する植物ホルモンの種類と量により、どのような組織に分化するかを制御できる(※ 高校理科の範囲内。)。
高いオーキシン濃度で、さらに低いサイトカイニン濃度という条件では、カルスは根に分化する。
いっぽう、高いサイトカイニン濃度、および、低いオーキシン濃度では、カルスは芽に分化する。(2016年現在の新課程生物でも、範囲内。数研出版や啓林館の検定教科書に記述あり。)
- (※ 出版社名を調査中. 新課程に説明追加されたらしい。) 繁殖の難しい植物や希少植物の場合に、組織培養が用いられる。観賞用のランの多くは、(※ 一般の方法では増殖が難しいので)組織培養によって(観賞用ランが)量産されている。
- 茎頂培養
- (2016年の現時点では、第一学習社がコラムで紹介(第一学習社、専門『生物』246ページ)。他の検定教科書には記述が見られない。旧課程の参考書(チャート式など)には記述あり。新課程では、資料集(実教出版)や参考書(チャート式)にも見当たらない。)
培養元の細胞片がウイルスに感染していると、培養中にウイルスごと培養して増殖してしまう。植物の茎の頂上である茎頂(けいちょう)の組織は、つねに成長分裂をしているので(茎頂分裂組織)、一般に、まだウイルスに感染していない(ウイルスフリー)。なので茎頂から採取した細胞片が、培養によく用いられる。(これを「茎頂培養」という。)
- ※ 第一の検定教科書には「ウイルスフリー」の語は無い。検索用に wikibooks では、この語を残す。
- やく培養
- (2016年の現時点では、検定教科書に記述が見られない。旧課程の参考書(チャート式など)には記述あり。)
おしべの やく から取った花粉も、培養できる。これをやく培養という。生殖細胞の核相は、減数分裂によって核相が体細胞の半分(核相:n)であるので、よって培養された細胞も半数体(核相:n)である。なので、そのままでは花粉などの生殖細胞をつくれず生殖できない。これにコルヒチンを茎頂に加えると、コルヒチンは細胞分裂での紡錘体の形成を阻害して倍数体をつくる作用があるので、半数体の核相が2倍になって、もとの核相(2n)に戻る。染色体の2本鎖の両方とは、もともと同じ半数体の染色体だったので、コルヒチン処理後の染色体の遺伝子は純系(ホモ)になっており、やく培養前の遺伝子とは異なっている。
短時間で純系の植物を培養したい場合に、よく利用される。
- 雑菌への対策 (高校理科の範囲外)
- 実際の培養では、あまり細菌が培養液などに繁殖しすぎないように工夫する必要があり、そのため器具の消毒・殺菌・洗浄や、実験者の手指などの消毒・洗浄などが必要である。とくに、培養液は栄養が豊富なので、雑菌には注意しなければならない。
- しかし、培養したい植物も生物なので、植物そのものを消毒しきれないので、なので培養中には、どうしても雑菌は混ざってしまうので、うまく工夫する必要がある。もし雑菌対策が実験で必要なら、高校なら教員が詳しいことは教えてくれるだろうから、高校生は深入りする必要は無い。
- 高校生の実験時での雑菌対策には設備などには限界があるだろうが、少なくとも実験前に手をよく洗浄することぐらいの対策は行っておこう。
農学などの応用の理由もあり、植物細胞の培養のバイオテクノロジーは、よく研究されているが、詳しい説明は高校理科の範囲を超えて、大学生物学や農学などの範囲になるので、説明を省略する。
動物組織の培養
[編集]一般に、発生後の多くの動物の細胞は、すでに分化を終えているので、培養しようと培養液につけても分裂・増殖できない。ただし例外として、発生中の動物細胞や、いくつかの動物を除く。
しかし、がん細胞は、発生後の個体から採取したがん細胞でも、培養できる。
がん研究などで、Hela細胞(ヒーラさいぼう)が用いられている。子宮がんで死んだアメリカ人女性ヘンリエッタ Henrietta Lacks の細胞である。1951年にHela細胞が実用化された。
- ハリソンのカエル神経細胞の培養
1907年、アメリカのハリソンはカエルの神経細胞を培養し、培養した神経細胞から神経繊維が突起を伸ばすことを観察した。
突然変異
[編集]植物に突然変異を起こしたい場合、放射線を用いる場合がある。 あるいは倍数体(核相が3nや4nなどのこと)を作りたい場合に化学薬品のコルヒチンを用いる事がある。(倍数体育種法) なお、コルヒチンそのものはユリ科のイヌサフランなどに含まれる。
通常の細胞は二倍体である。細胞分裂時の紡錘体の形成を、コルヒチンが阻害する。このため、細胞分裂時に倍増した染色体が両極に分かれず、そのまま四倍体の細胞になる。 たねなしスイカは三倍体などの倍数体であるので、種を持たないのである。
遺伝子組み換え以外のバイオテクノロジーもある
[編集]この単元では、おもに遺伝子組み換えの観点からテクノロジーを解説しているが、これら遺伝子工学的なテクノロジーのほかにも、多くのバイオテクノロジーがある。
たとえば動植物の伝統的な育成方法にも様々な知識や技術が必要だし、また、たとえば人工授精には発生の仕組みの理解が必要である。身近な食品などでも、たとえば納豆やヨーグルトなどの発酵食品だって、生物を利用した技術である。ほかにも、木材を用いた家具とか、イグサを用いたタタミとか、生物に由来する材料は多くある。そのような生物に関する様々な技術の原理を理解できるようにするため、読者は、けっして、この単元だけでなく、ほかの単元も学ぶ必要もあり、よって生物I・IIを全体的に学ぶ必要がある。
また、薬品も用いることが多いので、読者は化学なども勉強しなければならない。遠心分離機も使うことがあるから物理の力学も勉強しなければいけないし、電気装置や照明機器・光学機器なども用いることがあり、さまざまな物理を勉強しなければならない。
読者は勉強する事は多いが、あまり気負いしないようにして、とにかく、きちんと高校の各教科の教科書・参考書・問題集などにマジメに取り組めば良いだろう。
ヒトゲノム計画
[編集](未記述)
クローン動物
[編集](未記述)
ES細胞とiPS細胞
[編集]- (※ 範囲外 :)
iPS細胞は、体細胞に、ある4種類の遺伝子を入れるだけで分化全能性のある細胞になったのをiPS細胞というのである。では、どうやって、その4種類を特定したかというと、・・・
まず、ES細胞などの研究により、分化全能性をつかさどってる可能性のある遺伝子の候補を、24種類までに特定できた。
この24種類のなかには、分化全能性をつかさどるのに必要不可欠な遺伝子と、いっぽう、文化全能性には不要な遺伝子とが、混ざっており、一体どれが本当に必要な遺伝子かを、さらに調べる必要があった。
しかし、224(2の24乗)は16777216である。
そんな莫大な回数(16777216回)の実験をするのは無理だし、実際に山中伸弥らのグループはそのような実験はしてない。
山中らのグループは、24個の候補遺伝子から1個だけ遺伝子を抜いた23個の遺伝子を、使って実験したのである。
つまり、例えば、
- 20個の候補のうちの1番目の遺伝子だけを抜いた遺伝子グループを仮にAとして、
- 20個の候補のうちの2番目の遺伝子だけを抜いた遺伝子グループを仮にBとして、
- 20個の候補のうちの3番目の遺伝子だけを抜いた遺伝子グループを仮にCとして、
・・・
- 24個の候補のうちの24番目の遺伝子だけを抜いた遺伝子グループを仮にXとすれば、
たった24回の実験をするだけでよい。そして、山中らは実際に24回の実験をして、このようにして、山中のグループは、iPS細胞の発見にたどりついた。
なお、現状では、iPS細胞化のための4種類の遺伝子のひとつに、がん化を引き起こすウイルスから採取したDNAを使っているので、がん化のリスクがある。(※ 清水書院の社会科の資料集『現代社会ライブラリーへようこそ 2018-19』で紹介。)
脚注
[編集]参考文献
[編集]高校用の検定教科書・受験参考書などを確認のために参考してるが、どこの教科書にも書かれているような共通的な内容のため、引用などの特別な理由の無い限り、これら検定教科書および参考書については参考文献としての文献紹介を省略する。
バイオテクノロジーについては、検定教科書のほか、次の文献を参考にした。
- 大澤勝次ほか『植物バイテクの実際』農文教、2007年5月15日発行、第3刷
そのほか、大学用の教科書などを確認のため参考にしたが、高校範囲外なので、書名を高校生に知らせないほうが良いと考えて、特別な理由の無い限り、文献紹介を省略する。
ルシフェラーゼの記述の参考文献については、手元に文献が無いので書名を思い出せない。



