中学校理科 第1分野/化学変化と原子・分子
化学変化と原子、分子
[編集]ここでは物質の性質が保たれる最小の単位がw:分子であることを説明し、それらは個々の分子の性質をうまく扱うことで他の分子に変化させられることを説明する。また、具体的に分子の組成やw:化学変化の過程を記述する方法として、w:化学式(chemical formula)とw:化学反応式(chemical equation)を導入する。
物質の成り立ち
[編集]物質の分解
[編集]炭酸水素ナトリウムを加熱すると二酸化炭素と水が発生し、加熱後の物質は炭酸ナトリウムになる。また、酸化銀を加熱すると酸素が発生し、加熱後の物質は銀になる。
- 炭酸水素ナトリウム → 二酸化炭素 + 水 + 炭酸ナトリウム
- 酸化銀 → 酸素 + 銀
1種類の物質から2種類以上の物質に分かれる化学変化を分解という。
乾電池を用いた電気回路で、酸化銀に電気が通るか調べても、酸化銀は電気を通さない。一方、銀は電気をよく通す。なので、分解して別の物質に変わったことが分かる。
もとの物質とは異なる性質を持った物質ができる変化を化学変化(かがくへんか、chemical change)または化学反応(かがくはんのう、chemical reaction)という。分解も、化学変化である。
・分解の例
- 物質A → 物質B + 物質C + ・・・
物質の分解のやり方は、加熱の他にもある。電気を通しても、分解する。
電気を通すことによって物質を分解することを電気分解(でんきぶんかい、electrolysis、エレクトロシス)または略して電解(でんかい)という。
水を電気分解すると、+極には酸素、-極には水素が発生する。発生した水素の体積は酸素の2倍である。水は水素と酸素に分解できる。
・水の電気分解
- 水 → 水素 + 酸素
・発生気体の体積比
- 水素:酸素=2:1
塩化銅水溶液を電気分解すると、+極には塩素が発生し、-極には銅が付着する。塩化銅は塩素と銅に分解できる。
炭酸水素ナトリウムの分解実験
[編集]
- 炭酸水素ナトリウム ・・・ 重そう(じゅうそう、重曹)ともいう。 白色の粉末。
- 炭酸水素ナトリウム → 二酸化炭素 + 水 + 炭酸ナトリウム
- 二酸化炭素 ・・・ 加熱して発生した気体を石灰水にとおすと白くにごるので、二酸化炭素が発生したことが分かる。
- 水 ・・・ 塩化コバルト紙を、うすい赤色に変えるので、水が出来ていることが分かる。
- 炭酸ナトリウム ・・・ 水によく溶ける。水溶液はアルカリ性を示す。炭酸ナトリウムの水溶液にフェノールフタレイン溶液を入れると、アルカリ性なので赤色を示す。
酸化銀の分解実験
[編集]- 酸化銀 → 酸素 + 銀
- (※ 画像を募集中です。酸化銀の加熱分解実験の仕方の装置の組み立て図を描いてください。)
- 酸化銀 ・・・ 黒色の粉末。電気を通さない。
- 銀 ・・・ 白っぽい金属。電気を通す。(電気伝導性)
- 酸素 ・・・ 火のついた線香を入れると、線香が炎をあげて、はげしく燃える。(助燃性)
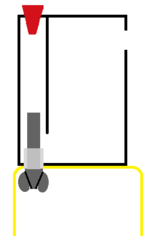
水の電気分解
[編集]-
1: 水の電気分解の実験用のH字管の説明図。
-
2: ピンチコックを閉めた後、H字管の上部から水酸化ナトリウム水溶液を入れる。水を入れた後、気泡が管内に残らないように上部のゴム栓をのせる。そしてピンチコックを開いて、ゴム栓をしっかりと押し込む。
-
3: 水の電気分解をすると、気泡が発生する。
- 電気分解装置による水の電気分解
-
1.電気分解装置を横から見た図。赤色の三角形がゴム栓、灰色のボルトのようなものが電極。
-
2.漏斗を使用して倒した装置に液体(この場合は水酸化ナトリウムを溶かした水)を注入している様子。
-
3.液体を注入した装置を戻した図。製作者が手を抜いたため水の容積が変わっている。
-
4.ようやく前面から見た図。赤色がゴム栓であることおよび灰色のボルトのようなものが電極であることなどは変わりなし。
-
5.分解中の様子。気泡が出ているほか、出た気泡により上部に気体が体積している。
実験では、うすい水酸化ナトリウムを溶かしたあとに、電流を流す。水酸化ナトリウムをまぜるのは、電気を通りやすくするため。 (※ 水酸化ナトリウムを扱うときはゴム手袋をする。また、液が目に入らないように安全メガネをする。もし、目に入ったら、すぐに水道水であらい、先生に報告して処置をあおぐ。)
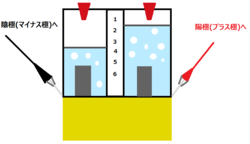
発生する気体について
- 陽極(+極側) ・・・ 酸素、 体積比=1
- 陰極(ー極側) ・・・ 水素、 体積比=2
気体の種類の確認方法
- 陰極の気体(水素) ・・・ 火のついたマッチを近づけると、気体がボッと音をたてて燃える。(水素の可燃性)
- 陽極の気体(酸素) ・・・ 火のついた線香を近づけると、線香が激しく燃える。(酸素の助燃性)
このように、水の電気分解では、水素と酸素が、体積比でかならず
- 水素:酸素=2:1
の割合で気体が発生する。
※ 発展: 光による化学変化
[編集]- ※ 教育出版や大日本図書などの検定教科書で紹介されている。
物質の分解が起きる現象は、いままでに紹介した、熱による分解 や 電気による分解の他にも、光による分解や化学変化がある。
理科室で使う薬品の液体でも、光によって化学変化しやすい物質は、保管中の化学変化をふせぐために、褐色(かっしょく)の容器に入れられて保管されているのが普通(ふつう)である。
また、さらに棚(たな)の中などの、棚を閉じた状態では光の当たらない場所に保管する事により、保管中の化学変化を防ぐ必要がある。
(※ 参考:) 理科室以外の物質でも光によって分解するものは、ある。よくポスターなどの印刷物の色が何年も経過すると消えることがある理由は、光によって、塗料が分解したことが、色の消える原因である。
原子と分子の記述
[編集]原子
[編集]すべての物質は、とても小さな粒子が組み合わさって出来ている。
- ・ 原子は、それよりも細かくは分解できない。
- ・ 原子は、種類によって、その原子の質量や大きさが決まっている。
- ・ 原子は、変化しない。化学変化をしても、無くなったりしないし、発生したりもしない。化学変化をしても、原子は他の種類の原子に変化しない。
原子の表記には、記号がつけられている。アルファベット1文字か2文字で書ける記号がつけられており、分子の構成を記述するためにはその記号を用いる。この記号はw:元素記号と呼ばれる。ここで、よく知られている原子の元素記号を列記しておく。
- 元素記号
- 水素 H
- 酸素 O
- 窒素(ちっそ) N
- 炭素 C
- 塩素 Cl
- 鉄 Fe
- マグネシウム Mg
- ナトリウム Na
- 銅 Cu
- 銀 Ag
- 金 Au
など。
書き方の決まりは、
- ・ 1文字目は大文字で書く。
- ・ 2文字の場合、2文字目は小文字で書く。
- たとえば銅の場合、 Cu と書く。 CU とか cu とは、書かない。
読み方の決まり
- ・ 英語のアルファベットどおりに読む。
- 例 ・・・ H「エイチ」、Cu「シーユー」、Fe「エフイー」
- 元素記号の読みかた
- 水素 H 「エイチ」
- 酸素 O 「オー」
- 窒素(ちっそ) N 「エヌ」
- 炭素 C 「シー」
- 塩素 Cl 「シーエル」
- 鉄 Fe 「エフイー」
- マグネシウム Mg 「エムジー」
- ナトリウム Na 「エヌエー」
- 銅 Cu 「シーユー」
- 銀 Ag 「エージー」
- 金 Au 「エーユー」
他にも様々な元素があり、それらはw:周期表などにまとめられている。周期表はそれぞれの元素を、ある順序に従って並べたものである。周期表の仕組みについて、あとの節で説明する。
ロシアのメンデレーエフによって、1869年に、周期表は作られはじめた。メンデレーエフは、まず原子質量の順に原子を表に並べた。すると、周期的に、化学反応などの性質の似た元素が表にあらわれる事を発見したのである。当時に、まだ知られていない元素があったが、それは、「未発見の元素があるのだろう」とメンデレーエフは考えた。のちに、メンデレーエフの予想したとおり、未発見の元素が、発見された。
- 水素原子の質量
原子の質量は、種類によってちがう。もっとも軽い原子は、水素原子である。
水素原子の場合、原子1個の質量は
- 0.000 000 000 000 000 000 000 0017 g
である。(17の前に、0が25個ついている。)
水素元素を集めて1gにするのに何個の原子が必要かというと、
- 600000000000000000000000 個 が集まって、( 6に10を23回、かけた数。)やっと1gになる。
- 元素記号の由来
(中学では、語源までは暗記する必要はない。) なお、元素記号の文字の由来は、おもにラテン語あるいはラテン語由来の英語やフランス語、ドイツ語などで表した場合の頭文字である。たとえば水素はラテン語で「hydrogenium」(ヒュドロゲニウム)と言い、英語では「hydrogen」(ハイドロジェン)と言い、それらの頭文字の h を大文字にして、Hという元素記号が水素に付けられた。
(水素「hydrogenium」などのラテン語の表記に関しては、中学では覚える必要はない。)
酸素の元素記号Oも、ラテン語の酸素 oxygenium(オキシゲニウム) などが語源である。英語では酸素は、
ラテン語由来の元素記号は、ナトリウムが分かりやすい例で、ラテン語ではnatrium(発音もナトリウム)といい、ラテン語の発音が、日本での発音とほとんど同じである。いっぽう英語ではナトリウムのことをsodium(ソウディウム)と言い、まったく違う発音である。なお、英語での表記は、ナトリウム化合物を日本語でソーダ(飲料水の「ソーダ水」とは別物。)と言うことなどに影響を残してる。 カリウムKも、英語ではpotassium(ポタシウム)と、まったく元素記号とは別の発音である。ラテン語ではカリウムはkalium(カリウム)と、元素名そのままである。
このように、必ずしも英語の発音に元素記号が近いとは限らない。原則的に、元素記号の表記と、元素名の発音は、ラテン語を語源としている。
銀のAgもラテン語の銀 argentum(アルゲントゥム) が語源である。英語の銀のsilverとは、まったくつづりも発音も異なる。 金のAuもラテン語の金 aurum(アウラム)が語源である。
ともかく、元素記号には、きちんとした根拠があるので、安心して元素記号を覚えてもらいたい。
また、化学の元素記号は世界共通である。たとえば水素だったら、どこの国でも水素の元素記号は H である。
分子
[編集]多くの物質では、原子がバラバラに存在していることは無く、いくつかの原子が結びついており、これが集まって物質になっている。
ある物質の分子は、その物質としての性質を持つ最小単位である。分子自身もいくつかの原子が組み合わさることで構成されている。
また、同じ原子からできていても、原子の配置によって異なった性質を示す分子ができる場合もある。そのため、ある分子がどの原子で構成されているかを知るだけでは、物質の性質を予測することはできない。また、反対にある分子がどのような原子でできているかを調べるには、物質ごとの特別な手段を用いる必要がある。ここでは既に性質がよく知られている分子だけを扱うが、分子の性質を調べる手法を知ることが重要である。
- 分子
分子は、原子の組み合わせでできている。分子が1種類の原子だけで構成されている場合、その分子の呼び名で、原子の名称を流用して用いる場合が多い。 たとえば、水素は、水素原子2つが結びついて水素分子を作る。水素の気体とは、水素分子が、いくつも集まった気体である。 酸素は、酸素原子2つが結びついて酸素分子を作る。酸素の気体とは、酸素分子が、いくつも集まった気体である。
例えば、気体の実験で用いる水素(水素分子)は、2つの水素原子からなっている。この分子の化学式は、
上の例は水素分子である。
酸素分子を元素記号で書くとき、酸素の元素記号Oを用いて、
と書く。
このような、元素記号を用いた分子の記述法をw:化学式と呼ぶ。ある分子の化学式を書くためには、その分子がどのような原子から構成されているかを把握している必要がある。また、化学式から分子の構成を読み取ることもできる。ただし、化学式からは分子の構成以上の情報は読み取れない。
ここで、Hは水素原子の元素記号であり、Hの右下に書かれた添字の2はそれが2つあることを表す。また、水素分子の例にあるように、分子中の原子の数は対応する元素記号の右下に小さい文字でつけるのが書き方である。

- 水(みず) H2O
水分子(みずぶんし)は、水素原子2個と酸素原子1個が結びついている。
H2Oの読み方は「エイチ・ツー・オー」と読む。
次に、よく知られた代表的な物質の化学式を書き記す。
- 水(みず) H2O
- 氷(こおり) H2O
- 酸素(気体の場合) O2
- 窒素 (気体の場合) N2
- 炭素 C
- 二酸化炭素 CO2
- 鉄 Fe
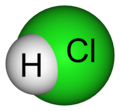
- 塩化水素(= 塩酸の溶質のこと) HCl
- 食塩 NaCl
- 二酸化マンガン MnO2
- 水酸化ナトリウム NaOH
-
酸素分子のモデル
-
二酸化炭素のモデル
-
塩化水素(塩酸の溶質)のモデル
読み方
- 水(みず) H2O 「エイチツーオー」
- 酸素(気体の場合) O2「オーツー」
- 窒素 (気体の場合) N2「エヌツー」
- 炭素 C「シー」
- 二酸化炭素 CO2「シーオーツー」
- 鉄 Fe「エフイー」
- 塩化水素(= 塩酸の溶質のこと) HCl「エイチシーエル」
- 食塩 NaCl「エヌエーシーエル」
- 二酸化マンガン MnO2「エムエヌオーツー」
- 水酸化ナトリウム NaOH 「エヌエーオーエイチ」
ここで、他の気体についても化学式をまとめておく。
- 酸素(酸素分子)
- 窒素(窒素分子)
- アンモニア
- 二酸化炭素
さて、
水素や酸素のように1種類の原子からできている純物質のことを単体(たんたい)と呼ぶ。
また、水分子やアンモニアや二酸化炭素のように2種類以上の原子からできている純物質のことを化合物(かごうぶつ)と呼ぶ。
いっぽう、複数の物質が混ざっているものを混合物(こんごうぶつ)という。食塩水は混合物である。砂糖水も混合物である。空気は混合物である。
塩化ナトリウムそのものは、塩素とナトリウムとが化合しているので化合物である。食塩水で、水に塩化ナトリウムが溶けていても、水分子と塩化ナトリウムは化合してはいないので、食塩水は混合物である。

塩化ナトリウムは結晶をつくっており、分子というまとまりを持たないが、原子数の比が、ナトリウム原子と塩素原子の比率は、かならず1:1なので、化学式を書くときは NaCl と書く。
鉄は結晶構造をとり、分子というまとまりを持たない。鉄では鉄原子Feが規則正しく並んでいるので、化学式では Fe で表す。
- (画像を募集中。鉄の結晶配置の図を描いてください。)
銅など、他の金属も同様で、結晶構造をとり、分子構造をとらないが、元素記号で分子を表す。
(* 発展 周期表の順序
各々の原子は実は物の最小単位では無く、原子はそれぞれw:原子核(げんしかく)とw:電子(でんし)から構成されている。実際には原子核もいくつかのw:中性子(ちゅうせいし)とw:陽子(ようし)から構成されているのである。個々の原子の違いはその原子の原子核が含む陽子の数と中性子の数によって決まるが、このうち原子の電気的な性質は陽子の数で決まる。周期表はその原子の原子核中の陽子の数によって元素を並べている。例えば、水素原子は陽子を1つ含むので1番目であり、酸素は8個含むので8番目である。また、周期表には各行で原子の数がまちまちだが、これにも理由がある。(これについては高等学校化学、w:遷移元素などを参照。)
周期表
[編集]中学の範囲において、この表の全てを記憶する必要はないが、原子番号1番から20番まで(カルシウム Ca まで)の20個を最低限は覚えておくとよい。
また、カリウムK、カルシウムCa、マンガンMn、鉄Fe、銅Cu、銀Ag、ヨウ素I(大文字のアイ)、金Au、などを覚えておくと良いだろう。
- (※ 21番より先の原子は、高校の知識が無いと勉強しづらい原子が多いので、あまり高校入試には出ない。)
- 第1周期…H:水素 He:ヘリウム
- 第2周期…Li:リチウム Be:ベリリウム B:ホウ素 C:炭素 N:窒素 O:酸素 F:フッ素 Ne:ネオン
- 第3周期…Na:ナトリウム Mg:マグネシウム Al:アルミニウム Si:ケイ素 P:リン S:硫黄 Cl:塩素 Ar:アルゴン
- 第4周期…K:カリウム Ca:カルシウム
- 周期表
| 1 | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 H 水素 |
2 | 13 | 14 | 15 | 16 | 17 | 2 He ヘリウム | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 Li リチウム |
4 Be ベリリウム |
5 B ホウ素 |
6 C 炭素 |
7 N 窒素 |
8 O 酸素 |
9 F フッ素 |
10 Ne ネオン | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 11 Na ナトリウム |
12 Mg マグネシウム |
3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 Al アルミニウム |
14 Si ケイ素 |
15 P リン |
16 S 硫黄 |
17 Cl 塩素 |
18 Ar アルゴン | ||||||||||||||||||||||||||||||||||||||||
| 19 K カリウム |
20 Ca カルシウム |
21 Sc スカンジウム |
22 Ti チタン |
23 V バナジウム |
24 Cr クロム |
25 Mn マンガン |
26 Fe 鉄 |
27 Co コバルト |
28 Ni ニッケル |
29 Cu 銅 |
30 Zn 亜鉛 |
31 Ga ガリウム |
32 Ge ゲルマニウム |
33 As ヒ素 |
34 Se セレン |
35 Br 臭素 |
36 Kr クリプトン | ||||||||||||||||||||||||||||||||||||||||
| 37 Rb ルビジウム |
38 Sr ストロンチウム |
39 Y イットリウム |
40 Zr ジルコニウム |
41 Nb ニオブ |
42 Mo モリブデン |
43 Tc テクネチウム |
44 Ru ルテニウム |
45 Rh ロジウム |
46 Pd パラジウム |
47 Ag 銀 |
48 Cd カドミウム |
49 In インジウム |
50 Sn スズ |
51 Sb アンチモン |
52 Te テルル |
53 I ヨウ素 |
54 Xe キセノン | ||||||||||||||||||||||||||||||||||||||||
| 55 Cs セシウム |
56 Ba バリウム |
*1 ランタノイド |
72 Hf ハフニウム |
73 Ta タンタル |
74 W タングステン |
75 Re レニウム |
76 Os オスミウム |
77 Ir イリジウム |
78 Pt 白金 |
79 Au 金 |
80 Hg 水銀 |
81 Tl タリウム |
82 Pb 鉛 |
83 Bi ビスマス |
84 Po ポロニウム |
85 At アスタチン |
86 Rn ラドン | ||||||||||||||||||||||||||||||||||||||||
| 87 Fr フランシウム |
88 Ra ラジウム |
*2 アクチノイド |
104 Rf ラザホージウム |
105 Db ドブニウム |
106 Sg シーボーギウム |
107 Bh ボーリウム |
108 Hs ハッシウム |
109 Mt マイトネリウム |
110 Ds ダームスタチウム |
111 Rg レントゲニウム |
112 Cn コペルニシウム |
113 Nh ニホニウム |
114 Fl フレロビウム |
115 Mc モスコビウム |
116 Lv リバモリウム |
117 Ts テネシン |
118 Og オガネソン | ||||||||||||||||||||||||||||||||||||||||
| *1 ランタノイド: | 57 La ランタン |
58 Ce セリウム |
59 Pr プラセオジム |
60 Nd ネオジム |
61 Pm プロメチウム |
62 Sm サマリウム |
63 Eu ユウロピウム |
64 Gd ガドリニウム |
65 Tb テルビウム |
66 Dy ジスプロシウム |
67 Ho ホルミウム |
68 Er エルビウム |
69 Tm ツリウム |
70 Yb イッテルビウム |
71 Lu ルテチウム | ||||||||||||||||||||||||||||||||||||||||||
| *2 アクチノイド: | 89 Ac アクチニウム |
90 Th トリウム |
91 Pa プロトアクチニウム |
92 U ウラン |
93 Np ネプツニウム |
94 Pu プルトニウム |
95 Am アメリシウム |
96 Cm キュリウム |
97 Bk バークリウム |
98 Cf カリホルニウム |
99 Es アインスタイニウム |
100 Fm フェルミウム |
101 Md メンデレビウム |
102 No ノーベリウム |
103 Lr ローレンシウム |
||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
書籍などでの実際の周期表には、つぎのように、原子番号や質量が、元素記号のとなりに書かれる。
- (水素原子を例にとった。)
左上の数字は原子番号で、左下の数字は炭素原子12Cの質量を12としたときの、その原子のおよその質量である。
書籍によっては、書く位置が違う場合もあるので、その書籍ごとに確認のこと。
それぞれの原子を羅列していくと、
- 元素の周期
- 第1周期
- 第2周期
- 第3周期
というようになる。
このような、水素原子Hの質量を1としたときの、ヘリウム原子Heの質量比4や、リチウム原子Liの質量比7、ベリリウム原子の質量比9など、水素原子の質量を1としたときの原子の質量比のことを
より詳しく言うと、現在では、原子量の基準には、炭素原子12Cの質量を12として、原子量の基準にしている。原子量は、一般の中学・高校の理科参考書の周期表を見れば、普通は記載されている。
原子番号と原子量を見ると分かるように、原子量は、元素番号のほぼ2倍だが、しかしピッタリ2倍とは、限らない。
元素記号のとなりに原子番号や原子量を書くときは、周期表を書くときなどに限る。ふつうの化学反応式では、反応式中に原子番号や原子量を書かないのが、普通である。
水素からネオンまで、第一周期から第二周期の終わりまで(横方向)、語呂合わせで「
なお、リーベとはドイツ語で「愛する」と言う意味。水兵が船を愛している、という内容。
このあと、「
さらにそのあと、「
ほか、おそらく平成あたりからだろうが、1族(縦方向)の水素、リチウム、ナトリウムを「
w:元素記号に語呂合わせの例がある。
中学では、「水平リーベ僕の船」「名もあるシップス クラークか 」と「エッチなリナちゃん」あたりの元素を覚えていれば、あとはカリウムK、カルシウムCa、マンガンMn、鉄Fe、銅Cu、銀Ag、ヨウ素I(大文字のアイ)、金Au、だけ覚え足せば済む。
この程度の元素の順番と位置を覚えておけば、あとは実用的には語呂合わせがあるのを知っていれば十分である。忘れたら実務では周期表を見れば済む。大学入試ではどうだか知らないが。
化学変化と物質の質量
[編集]物質の化合
[編集]- 硫化鉄
鉄(てつ)の粉末と硫黄(いおう)の粉末の混合物を加熱すると、硫化鉄(りゅうかてつ)という黒色の粉末ができる。 加熱する前の、鉄と硫黄がまざっただけの粉末は、黄色がかった灰色である。
- 鉄 + 硫黄 → 硫化鉄
- Fe + S → FeS
硫化鉄の化学式は FeS である。
加熱する前の鉄の粉末と硫黄の粉末の混合物は、磁石につく。(鉄粉が磁石につくため) しかし、加熱したあとに出来る硫化鉄の混合物は、磁石につかない。
このように、化学変化をすると、物理的な性質が変わる。
硫化鉄の化学式 FeS もテストに出るので、覚えておこう。このFeSのできる反応は、どの検定教科書にも書いてある代表的な反応なので、おぼえておくこと。
- 硫化銅
また、銅と硫黄の混合物を加熱すると硫化銅ができる。
- 銅 + 硫黄 → 硫化銅
このように、2種類以上の物質が結びついてもとの物質と違う別の1種類の物質ができる化学変化を化合(かごう)という。化合した物質を 化合物(かごうぶつ、chemical compound) という。
- 酸化銅
銅の粉末を加熱すると、銅が空気中の酸素と化合して酸化銅(さんかどう)ができる。酸化銅は、銅と酸素の化合物である。また、炭素を加熱すると、炭素が空気中の酸素と化合して酸化銅ができる。
- 銅 + 酸素 → 酸化銅
化学反応式
[編集]既にいくつかの場合に、複数の物質が反応し別の物質を作る過程を見てきた。ただし、一口に反応といってもその種類は様々であり、熱を発する物や、複数の物質を生じる物があることには注意が必要である。扱った過程の中には、いくつかの分子から別の分子を生じる過程もあった。例えば、過酸化水素水から水と酸素が生じる反応はこの例である。これらの反応は、どれも分子と分子の反応であり、反応の中で個々の原子が変化することはない。この理由については下の発展を参照。
- 発展 原子核が変化する反応
一般に、通常では原子核は変化しないが、とても大きなエネルギーを加えた場合には変化させることも可能である。このような原子が他の原子に変化する反応はw:核反応(かくはんのう)と呼ばれ、一般にここで扱う反応より高いエネルギーが必要になる。ただし、元々不安定な元素は、勝手に原子核中の中性子が崩壊し、他の元素に変化する場合がある。(詳しくは、w:ベータ崩壊などを参照。) 次に述べる化学反応は、核反応とは異なるので混同しないように注意のこと。
それぞれの分子を化学式で記述する方法を既に学んだ。同じように反応の過程も化学式と似た記号で記述できると便利である。このような記述法をw:化学反応式(かがくはんのうしき、chemical equation)と呼ぶ。化学反応式は化学反応を記述するための一般的な方法だが、反応の詳細(例えば、熱を発するかどうかや反応が進む速度)については記述できないことに注意が必要である。
化学反応式を書くときには真ん中に矢印を書き、左側に反応前の物質の化学式を書き、右側に反応後の物質の化学式を書く。また、複数の物質があるときにはその間に+記号を置く。例えば、上であげた過酸化水素水が水と酸素に分解する反応は次のようになる。
ここで、それぞれの分子の化学式の前の数字は、反応に関わる分子の数を表す。上の反応では2つの過酸化水素水分子に対して2つの水分子と1つの酸素分子が生じる。このとき全体に定数をかけても関係は変わらないが、それぞれの定数が公約数1を持つ整数に取る必要がある。
反応中で原子が変化しないことから、式の左辺と右辺で分子の数は変化しない。上の例では、左辺でも右辺でもHが4つと、Oが2つ存在する。
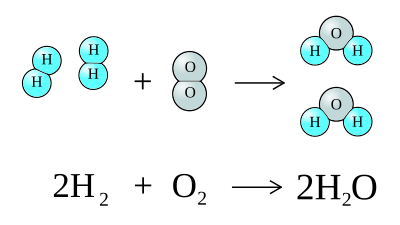
- 水の合成
水素と酸素から、水を合成する反応は、つぎの反応式になる。
図示すると、つぎのような図になる。
この水の合成実験は、けっこう危険なので、教員の指示がない限りしなくてよい。
図を見ると分かるように、反応の前後で、原子の個数は変化していない。
化学変化と質量
[編集]鉄を熱したとき、鉄に酸素が結合して酸化鉄になるが、その化合した酸素の分だけ質量が増える。
- 鉄の質量 + 酸素の質量 = 酸化鉄の質量
化学変化の前後で、その変化に関係している物質全体の質量は変わらない。これを質量保存の法則(しつりょうほぞんのほうそく、law of conservation of mass)という。
- ※ なお、教科書には酸化鉄の化学式が書かれてないのが、ふつうである。その理由は、じつは酸化鉄の化学式は3種類あり、FeO 、Fe2O3 、 Fe3O4 の3種類があるからであ。
気体の生じる化学反応
[編集]炭酸水素ナトリウム(NaHCO3)と塩酸(HCl)を反応させると、二酸化炭素が発生する。
- 炭酸水素ナトリウム + 塩酸 → 二酸化炭素 + 塩化ナトリウム + 水
- NaHCO3 + HCl → NaCl + CO2 + H2O
密閉されていない容器の中でこの反応をさせると、発生した二酸化炭素は空気中に逃げていくので、反応前後の質量を比べると、反応後は質量が減少している。
いっぽう、密閉された容器の中で反応させると、発生した二酸化炭素は空気中に逃げていかないため、反応前後の質量は変化しない。
このように、気体が発生する反応でも、質量保存の法則は成り立つ。
なお、この炭酸水素ナトリウムと塩酸の反応でできた液体は、塩化ナトリウムと水の混ざったものである。
化学式も覚えよう。
- 炭酸水素ナトリウム NaHCO₃
- 塩酸 HCl
※ 炭酸水素ナトリウムそのものは、あまり質量保存の法則では重要ではないのだが、この炭酸水素ナトリウムの実験はどの教科書にも書かれる有名な実験なので、テストにも入試にも出るだろうから、覚えておこう。
沈殿のできる反応の場合
[編集]水溶液中の反応で、沈殿ができても、質量保存の法則は成り立つ。
- 硫酸と塩化バリウム水溶液の反応
塩化バリウム水溶液(BaCl2 ) に、硫酸(H2SO4)をくわえると、硫酸バリウム(りゅうさんバリウム)(化学式: BaSO4)の白い沈殿ができる。
- 硫酸 + 塩化バリウム → 沈殿物(硫酸バリウム) + 塩酸
- H2SO4 + BaCl2 → BaSO4 + 2HCl
てんびんなどで、重さを実際に測ってみると分かるのだが、化学反応の前後で、重さは変わらない。
このように、沈殿が生じたところで、合計の質量は変わらず、よって質量保存の法則は成り立つ。
なお、この実験での質量の測定には、「電子てんびん」を用いるのが一般的。実験の前後で、ビーカーごと、電子てんびんに載せる。くわしくは、教科書や参考書の図を参照せよ。
反応後には、塩酸も出来る。
化学式も覚えよう。
- 硫酸バリウム BaSO4
- 塩酸 HCl
※ 硫酸バリウムそのものは、あまり質量保存の法則では重要ではないのだが、この硫酸バリウムの実験はどの教科書にも書かれる有名な実験なので、テストにも入試にも出るだろうから、覚えておこう。
- (※ 範囲外)余談だが、レントゲン等で用いる造影剤の硫酸バリウムは、今回の実験で生成したような BaSO4 と同じ物質である(受験研究社)。
密閉した容器内での実験
[編集]- 密閉した容器内での石灰石と塩酸の実験
密閉した容器内で、石灰石とうすい塩酸を反応させる実験でも、質量保存の法則が成り立っている事を確認できる。(受験研究社、旺文社)
フタのある、密閉した容器を使えばいい(容器の形状は、検定教科書などを参考にせよ)。
もちろん、事前に、反応前の全体の質量も測定しておく。そして、反応後の全体の質量も測定すれば良い。
電子てんびんで、普通に測定できる。
※ 詳しい実験手順は、検定教科書などを参考のこと。
定比例の法則
[編集]金属を熱したとき、化合した酸素の分だけ質量が増える。しかし、たとえ酸素がじゅうぶんに存在しても、一定量の金属に化合する酸素の質量には限界がある。また、金属の質量と化合した酸素の量の質量の間には比例の関係がある。
化合する物質の質量の比は一定である。これを定比例の法則(ていひれいのほうそく、law of definite proportions)という。例えば、銅の質量と酸素の質量との比はつねにであり、マグネシウムの質量と酸素の質量との比はつねにである。
酸化と還元
[編集]酸化
[編集]物質が酸素と化合することを酸化(さんか、oxidation、オキシデイション)という。
- 物質A + 酸素(O2) → 物質B
たとえば、銅(Cu)が酸化して酸化銅(CuO)ができる反応がある。
- 2Cu + O2 → 2CuO
燃焼(ねんしょう、combustion、コンバスチョン)とは、化学反応により発熱現象が激しく進行することである。発熱の際に発光を伴うことも多い。
可燃物は、酸素との反応で燃焼をする。 (燃焼とは、必ずしも酸素との反応だけでなく、フッ素と反応して燃焼することもある。中学レベルでの燃焼は、酸素との化合による燃焼を扱う。)
酸化は必ずしも燃焼反応とは限らず、ゆっくり進む場合もある。金属のサビなどは、酸化がゆっくり進んだ現象である。
- 鉄の燃焼
繊維上の鉄を スチールウール(steel wool) という。色は銀白色である。スチールウールは表面積が大きいので、火であぶると燃焼しやすい。
スチールウールを酸素中で熱すると、激しく反応し、酸素と化合し燃焼する。スチールウールを燃やすと、酸化鉄(さんかてつ、iron oxides)になる。
- 鉄 + 酸素 → 酸化鉄 + 熱・光
燃焼前のスチールウールは鉄なので磁石につくが、酸化鉄は磁石につかなくなる。
この酸化鉄の重さは、スチールウールよりも重い。この重さの増加は、酸素が化合して質量が増加したためである。質量を測るには、天びんを用いれば良い。反応前に、あらかじめスチールウールの質量を測定しておいて、反応後の酸化鉄の質量も同様に測定すれば良い。
酸化鉄にはいくつかの種類があり Fe3O4 や Fe2O3 や FeO などがある。スチールウールの燃焼実験ではこれらの物が混在する。
スチールウールの燃焼実験での、燃焼後のスチールウールの外側の表面成分は Fe3O4 が多い事が多いので、これをスチールウールの燃焼反応における酸化鉄の化学式として採用することが多い。
燃焼前のスチールウールは、薄い塩酸にいれると、泡が発生し、また、スチールウールが溶ける。このときの発生した泡は水素である。
鉄 + 塩酸 → 塩化鉄 + 水素
- Fe + 2HCl→FeCl2 + H2
いっぽう、燃焼後の酸化鉄を薄い塩酸に入れても、泡は発生せず、水素は発生しない。ただし、塩酸と反応しないわけではなく、塩化鉄が生成する。
酸化鉄 + 塩酸 → 塩化鉄 + 水
- FeO + 2HCl → FeCl2 + H2O
このように、酸化鉄は、鉄とはちがう化学的性質を持つ。これらの実験からも鉄と酸化鉄とは、べつの物質であることが分かる。
- 炭素の酸化
木炭など炭素は、酸素と反応すると、二酸化炭素になる。
- 炭素 + 酸素 → 二酸化炭素
- C + O2 → CO2
図にすると、つぎのようになる。
発生後の気体が二酸化炭素であることを確かめる方法には、石灰水に気体を通せば白くにごることから、発生した気体が二酸化炭素であることが分かる。
もし、ある物質を燃やした時に二酸化炭素が生成すれば、その物質は炭素を含んでいたことになる。
木材や紙などを燃やした時に、反応後の燃えカスの質量が、反応前よりも軽くなったりするのは、反応によって生じた二酸化炭素や水蒸気などが空気中に散っていったからである。
ロウソクを燃やした時にロウが減っていくのも、反応によって生じた二酸化炭素や水蒸気が空気中に散逸していくからである。
炭素を含む化合物には、木材の他にも、砂糖やエタノールやロウなどがある。
木材などの炭素を含む有機物は、空気中で燃やすと、木材中の炭素と空気中の酸素とが反応して二酸化炭素ができる。
- マグネシウムの燃焼
マグネシウムをリボン状の形にしたものを マグネシウムリボン という。マグネシウムリボンに火をつけて空気中で燃焼させると、酸素と反応し、明るい炎をあげて燃え、酸化マグネシウムになる。
- マグネシウム + 酸素 → 酸化マグネシウム + 光・熱
- 2Mg + O2 → 2MgO
酸化マグネシウムの化学式は MgO である。
マグネシウムには光沢があるが、酸化マグネシウムには光沢はない。 一般に酸化物は、光沢を持たない。酸化マグネシウムの色は白色である。
反応後の物質が、反応前のマグネシウムとは別の物質であることは、次のようにして確かめられる。
反応前と後のマグネシウムのどちらとも、塩酸に入れると溶ける。燃焼前のマグネシウムは、うすい塩酸にいれると泡(水素)が発生する。だが、燃焼後の物質(酸化マグネシウム)をうすい塩酸に入れても反応せず、また、泡も発生しない。
燃焼後の物質(実は酸化マグネシウム)の質量を測定すると、反応前のマグネシウムよりも、反応後は質量が大きくなっている。これは酸素がマグネシウムに化合したため、そのぶんの質量が増えたかあである。
酸化マグネシウムの化学式 MgO は簡単な化学式なので、テストに出やすいので、覚えておこう。
- 水素の燃焼
水素(すいそ)は、酸素と反応すると、水になる。 したがって、もし、ある物質を燃やした時に水が生成すれば、その物質は水素を含んでいたことになる。
- 水素 + 酸素 → 水
- 2H2 + O2 → 2H2O
- 銅の酸化
空気中で銅粉(どうふん)を熱すると、酸化銅(さんかどう、copper oxide、カッパーオキサイド)になる。酸化銅の質量は、酸素が化合したぶんだけ、反応前よりも質量が増えている。
なお、酸化銅には CuO と Cu2O とがある。色はCuOが黒色で、Cu2Oが赤色だが、どちらとも、もとの銅の光沢を失っている。 たとえば、銅(Cu)が酸化して酸化銅(CuO)ができる反応の場合、化学反応式は
- 2Cu + O2 → 2CuO
となる。
還元
[編集]黒色の酸化銅である 酸化銅CuO と、 炭素C を混ぜたものを熱すると、赤褐色の粉末になる。 これは、酸化銅が銅に戻った反応である。
- 酸化銅 + 炭素 → 銅 + 二酸化炭素
化学反応式は以下の式になる。
- 2CuO + C → 2Cu + CO2
酸化銅と化合していた酸素は、炭素と反応して二酸化炭素となり、その二酸化炭素は散っていったからである。 炭素は銅から酸素を奪う反応をしたことになる。
このように酸化の逆である、酸素を奪う反応を反応を還元(かんげん、reduction)という。酸化銅と炭素との反応で、酸化銅は還元されたことになる。(還元: 酸化銅→銅) また炭素は、酸化銅を還元したことになる。
いっぽう、炭素自身は酸素と化合して二酸化炭素になったのだから、炭素は酸化したことになる。(酸化: 炭素→二酸化炭素)

このように、ある物質が還元する時は、かならず、同時に別の物質が酸化をしていることになる。
- 水素をもちいた酸化銅の還元
酸化銅の還元は炭素でも可能だが、水素を用いても酸化銅を還元することができる。 ガラス管につめた酸化銅に水素を通して熱すると、還元できる。還元をすると、水素と酸素が化合して水ができるので、ガラス管の内側が水蒸気でくもる。
- 酸化銅 + 水素 → 銅 + 水
- CuO + H2 → Cu + H2O
酸化銅の還元で用いた水素や炭素のように、酸化物から酸素を奪う働きのある物質を還元剤(かんげんざい)という。
酸化されたのは、水素。(H→H2O) 還元されたのは、酸化銅。(CuO →Cu)
おもな化学反応式
[編集]- 酸化
・鉄(スチールウール)の燃焼。(酸化)
- 3Fe + 2O2 → Fe3O4
・マグネシウムの燃焼
- 2Mg + O2 → 2MgO
・銅の酸化
- 2Cu + O2 → 2CuO
・炭素の酸化(燃焼)
- C + O2 → CO2
- 分解
・過酸化水素水の分解
- 2H2O2 → 2H2O + O2
・炭酸水素ナトリウムの分解
- 2NaHCO3 → Na2CO3 + H2O + CO2
・酸化銀の分解
- 2Ag2O → 4Ag + O2
・水の分解(電気分解)
- 2H2O → 2H2 + O2
- その他
・塩酸(HCl)と水酸化ナトリウム(NaOH)の中和反応
- HCl + NaOH → NaCl + H2O
・石灰水(水酸化カルシウム水溶液)と二酸化炭素とで、石灰水の白くにごる反応
- CO2 + Ca(OH)2 → CaCO3 + H2O
・塩酸(HCl)と亜鉛(あえん、Zn)の反応
- Zn + 2HCl → ZnCl2 + H2
・銅と硫黄の化合
- Cu + S → CuS
・鉄と硫黄の化合
- Fe + S → FeS
・硫化鉄と塩酸の反応
- FeS + 2HCl → FeCl2 + H2S
化学変化とエネルギー
[編集]発熱反応
[編集]化学変化をする際、熱エネルギーを放出する物質があり、この反応を発熱反応という。
燃焼などの反応は、典型的な、発熱反応である。
ただし、見た目は、炎などが起きなくても、発熱反応をしている物質も多い。
燃焼においては、熱のほかにも光も発しているが、どちらにせよ発熱反応である事には、かわりない。
ここでいう「燃焼」とは、ふつうに木炭やロウソクなどが燃える燃焼のことである。
燃焼のほか、酸とアルカリとの中和反応も、ふつうは発熱反応である。(※ どの参考書にも書いてあります。 受験研究社と旺文社の参考書で確認。)
温度は、エネルギーではありません(受験研究社)。
なので、もし、たとえば中和で発熱したエネルギー量を測定したい場合には、温度計の温度だけを測定するのではなく、溶液の量もあらかじめ測定し、また、加えた酸またはアルカリの量も、記録をしてください。
温度だけを記録しても、エネルギー量がわからず、あまり役立ちません。
- ※ さらに、対照実験として、同量の水を用意した別のビーカーなどもあると望ましいでしょう。また、温度を測定する実験ですので、教室(または理科室)の気温も、測定しておくのを、忘れないように。
発熱反応が燃焼を起こすものの場合、その熱のことを「燃焼熱」(ねんしょうねつ)という場合もあります(旺文社)。
- ※ 燃焼による熱の測定は、大きすぎるので、中学高校の理科室では、測定が出来ません(旺文社)。
吸熱反応
[編集]硝酸アンモニウムを水に溶解させると、温度が低下します(旺文社)。
ほかにも、水酸化バリウムに塩化アンモニウムを加えると、アンモニアが発生し、熱を吸収します(旺文社、受験研究社)。
このように、反応することで、物質が熱を吸収することを、吸熱反応と言います。
化学エネルギー
[編集]
物質そのものがエネルギーを蓄えていると考えると、つじつまが合います。
反応前の物質がもつエネルギーの総和と、反応後の物質のもつエネルギーの総和との、差によって、発熱反応なのか吸熱反応なのかが、決まります。
たとえば、燃焼などの発熱反応なら、反応前のもつ物質のほうがエネルギーの総和が大きく、反応後の物質のエネルギーの総和が小さいので、物質内に行き場をうしなったエネルギーが外部にもれるという、エネルギーの放出をされることで、発熱反応となっている、という仕組みです。
- (熱としての放出のほかにも、光としての放出の場合もありますが、説明を簡単にするために、深入りしないことにします。)
このように、化学的な物質がもつエネルギーのこと(受験研究社)、あるいは、反応によって生じる発熱エネルギー量 または 吸熱エネルギー量 のことを(旺文社)、化学エネルギーと言います。
化学エネルギーは、よく右の図のように、高さの差のような図で、説明される事もあります。
- ※ 右のような図では普通、加熱をしないと作れない物質の側が、エネルギーの高い状態です。
化学エネルギーは、どの状態や物質を基準にするかで、それぞれの物質の1gあたりのエネルギー量が変わってきます。(旺文社と受験研究社との説明に、微妙にちがいがあるのは、この理由です。)
なので、文脈によって、どの物質や状態を基準においてるかを、知る必要があります。
また、もし、実験や測定などをするような場合にも、そういった文脈を読者が知れるように、実験条件などの情報を残しておきましょう。
ほか、あまり実用性はないですが、酸化金属などの還元反応は、ふつう、吸熱反応です。(金属の酸化反応が発熱反応であることの逆です。)
たとえば、酸化鉄を炭素で還元する反応は、吸熱反応です。なので、酸化鉄を還元する場合には、加熱をする必要があるのです。
だから鉄鉱石から鉄をつくりだす場合には、炭素を加えるだけではなく、さらに加熱が必要なのです。
- ※ 関連させて、覚えましょう。
ほか、合成や分解といった、せまい意味での化学反応のほかにも、水が氷(こおり)になったり水蒸気になったりする場合にも、エネルギーの吸収などの変化があるので、化学エネルギーという言葉を使う場合もあります。
- ※ 受験研究社が写真で紹介。旺文社も、写真は無いが、文章で実は紹介している。
いわゆる「ホッカイロ」(商品名かもしれません)などの「化学かいろ」は、しくみは、普通は、金属の酸化反応です。
「かいろ」商品内に、酸化していない鉄粉などが入っており、それを使用時に酸化させることで、発熱をさせる商品です。
反応をおだやかに調節するために、鉄粉以外の物質が加えられている場合もある。
- ※ おそらく資料集にもある。
- ※ 教師も口頭で説明するはず。
- ※ 特定の企業の商品のしくみなので、受験問題としては、出題されづらいだろう。なので、旺文社が写真では紹介しないのにも、一理ある。
練習問題。カイロの化学エネルギーは、増加したのか、それとも減少したのか。
答え カイロは、発熱してエネルギーを放出するわけですので、そのぶんの
なお、上述のいろいろな化学エネルギーを細かく測定しようとしても、実際には、周囲の加熱などにも使われるので、正確なエネルギー量の測定は、むずかしい。
化学エネルギーと生命活動
[編集]人間やイヌなどのすべての動物や、植物なども、発熱反応をしています。
私たち人間などの動物が、炭水化物を食べるのも、このためです。
炭水化物はつまり、炭素や水素の含まれている物質です。動物の体内では、一般的にはブドウ糖などの糖分の形に変えて、体内でたくわえます。
そして、このブドウ糖などを、体内でうまく反応させることで、熱エネルギーを取り出し、うまく生命活動を行っています。
ブドウ糖も、炭素をふくんでいるので、有機物です。そして。有機物の酸化は、ふつうは、発熱反応です。
そして有機物の酸化には、当然ですが、酸素が必要です。
私たち人間などの動物が呼吸をするのも、この酸化のためもあります。
呼吸によって体内に取り入れられた酸素は、ブドウ糖などの酸化にも、つかわれます。(そして、発熱反応によってエネルギーが放出されます。)
※ 発展
[編集]発展: 反応熱の単位
[編集]- ※ 自由研究社の参考書で、ジュールとの関係まで教えている。
化学反応や状態変化に伴って熱エネルギーの出入りが起こる時の熱のことを反応熱(heat of reaction)という。反応熱には「燃焼熱」、「溶解熱」(heat of dissolution)、「中和熱」(heat of neutralization )、「生成熱」、「融解熱」、「蒸発熱」(heat of evaporation)、「昇華熱」などがあるが、どれも熱量の単位には J (ジュール) を使う。1cal = 4.184Jである。反応熱の表記は、物質量1molあたりの熱量(単位は[kJ/mol] 。 1kJ = 1000J である )で現すことが多い。1ジュールとは、力の大きさ1ニュートンで移動距離1メートルの仕事をすることである。つまり、1J=1N・mである。
- 練習問題
問い 燃焼熱は、発熱反応でしょうか、吸熱反応でしょうか?
- 答え ふつうは、燃焼熱は発熱反応です。
- ※ 分からないなら、発展の前の「発熱反応」の説明文を、お読みください。
問い 酸とアルカリが反応して水ができる中和反応のときの中和熱は、発熱反応でしょうか、吸熱反応でしょうか?
- 答え ふつうは、中和熱は発熱反応です。
問い 生成熱は、発熱反応でしょうか、吸熱反応でしょうか?
- 答え どちらの場合もあります。
- ※ 分からないなら、発展の前の「発熱反応」と「吸熱反応」の説明文を、お読みください。ヒントが書いてあります。
なお、溶解熱は、発熱反応と吸熱反応、どちらの場合もあります(受験研究社)。
発展の発展: 熱化学方程式
[編集]- ※ おそらく中学の範囲外ですが、編集の都合で、紹介しておきます。
- 参考のていどに、してください。。
化学反応式の右辺に反応熱を記し、両辺を等号で結んだ式を熱化学方程式(thermochemical equation)または熱化学反応式という。 たとえば、炭素(黒鉛)の1molを燃焼させた場合の熱化学方程式は以下のようになる。
- C(黒鉛)+O2(気) = CO2(気)+394kJ
反応熱は、上の式のように右辺に表す。
- 反応熱は、発熱反応のときは+の符号で表し、吸熱反応のときは-で表す。
- 物質のもつエネルギーはその状態によって異なるので、原則として化学式に物質の状態を気体のときは(気)(g)、液体のとき(液)(l)、固体のとき(固)(s)、水溶液や大量の水はaqのように付記する。また、炭素など特別な物質は黒鉛やダイヤモンドなどのように表す。
- g は gas(ガス) の g です。gas とは英語で「気体」の意味です。 s は solid(ソリッド) の s です。solid は英語で「固体」の意味です。 aq は「アクア」aqua です。
- 熱化学方程式は物質1molがもつエネルギーをを表す(反応物質や副産物を分数で示すこともある)。
備考
[編集]プラスチック
[編集]プラスチックは、数百個や数千個などの、いくつもの原子がつながった、巨大な分子である。
デンプンやタンパク質など
[編集]デンプンは、炭素Cや水素Hや酸素Oをふくむ分子が、数百個や数千個などの、いくつもつながって作られた、巨大な分子である。 植物が光合成をして二酸化炭素を吸いこむのは、このデンプンをつくるための炭素Cを、植物が手に入れるためである。
デンプンを燃やすと、炭になる。なので、デンプンが炭素をふくんでいることが分かる。
また、砂糖を燃やすと炭になる。なので、砂糖が炭素をふくんでいることが分かる。
金属材料
[編集]製鉄
[編集]製鉄所(せいてつじょ)での、鉄の製鉄は、以下のとおり。

Trocken -und Vorwärmzone:乾燥および予熱
Reductionzone :還元の領域 。 Kohlungzone :浸炭の領域
Schmelzzone :融解の領域 。
Roheisen :銑鉄
schlacke :スラグ
Erz :鉱石 。 koks :コークス 。 zuschläge :追加物
Gichtgas :高炉ガス

鉄の原料は鉄鉱石(てっこうせき、iron ores)です。
この鉄鉱石に、酸化鉄(さんかてつ)がふくまれている。
製鉄会社では、高炉で鉄鉱石を溶かすさい、酸化鉄を還元するため、「コークス」といわれる炭素のカタマリ(石炭をむしやきにして出来る炭素のかたまりが「コークス」です)をくわえて、最終的に鉄や鋼が作られます。
なお、鉄鉱石の還元のさい、酸素と炭素が反応するため、二酸化炭素が発生します。
- 鉄鉱石 + コークス(炭素) → 鉄 + 二酸化炭素
ここでは、コークス(炭素)jは、還元剤として用いています。
還元反応と関連させて、鉄の精錬(せいれん)の化学式を覚えましょう。
- 高炉(こうろ)
鉄をつくるには、鉄鉱石から、製鉄所にある高炉(こうろ)で鉄を溶かします。高炉の高さは100m(メートル)以上もあります。高炉で溶かした鉄が、銑鉄(せんてつ、pig iron)です。
なお、高炉の内側には、耐火性のレンガが内貼り(うちばり)してある。このレンガによって、高炉は、溶けた熱の高温に耐えられるようになっている。
鉄鉱石は、酸化していて、さびています。鉄鉱石を溶かす時に、さびをとるため、炭素をふくんでいる石炭をむしやきにしたコークス (ドイツ語:Koks) を加えています。コークス中の炭素と、鉄鉱石とが反応します。つまり還元(かんげん)反応です。酸化の反対の反応を、つまり酸化した物質から酸素が失われる反応を還元(かんげん、reduction)と言います。
反応熱で、高炉中は高温になり、鉄が溶けます。
銑鉄は、高炉の中で下に液状になって、たまり、炉の下のほうから取り出されます。
この炭素が鉄に多くまざると、鉄はかたくなり、もろくなる。銑鉄には炭素が多くあるので、銑鉄は、かたくてもろいです。銑鉄に、ふくまれる炭素の濃度は、だいたい4%から5%まで、です。この炭素の濃度だと、銑鉄が、やや低い温度で溶けやすくなるので、結果的に、銑鉄の濃度が、こうなります。
不純物は、酸素の他にも、ふくまれてるので、コークスの他に、石灰石(せっかいせき)を加えています。
- 転炉(てんろ)
鋼(はがね)とは、銑鉄を転炉(てんろ)という炉に送り、転炉で酸素(さんそ)を吹き込むことで、炭素を燃焼(ねんしょう)させて減らし(へらし)、ちょうどいいぐあいにまで炭素を減らすことで、丈夫(じょうぶ)な鋼(はがね)に、なります。ねばりが ありながら、しかも かたくなるように、炭素の量を調節した鉄です。鋼にふくまれる炭素の量が、どのくらいかと言うと、0.02% から 2.1%までの炭素濃度です。
転炉のあと、さらに圧延機におくられ、板のかたちの鋼板(こうばん)や、棒のかたちの棒材(ぼうざい)などへと、加工されます。
鉄や鋼をあわせて、鉄鋼(てっこう)と、よびます。
鉄鋼を生産している産業を鉄鋼業(てっこうぎょう)と言います。
なお、ステンレス鋼(ステンレスこう、Stainless steel)とは、鋼(はがね)にニッケルやクロムを加えた合金です。
アルミニウムをつくったり、銅をつくったりなど、鉄鋼以外の金属を生産するのは、金属工業と言います。アルミや銅の生産は、鉄鋼業とは言いません。
ステンレス
[編集]ステンレスは、鉄(てつ)Feをおもな成分として、鉄に、クロム(元素記号: Cr)やニッケル(元素記号: Ni)が加わった合金である。
「ステンレス」の語源は、「stain less」であり、さび(stain) が ない(less)、という意味。
鉄の合金のことを鋼(はがね、英:steel)というので、正確には「ステンレス鋼」(ステンレスこう、stainless steel)という。
※ 参考: 塗装
[編集]- ※ 教師がよく口頭で話す内容。
鉄の「さび」と言われるものは、一般的に、鉄が酸化したものです(つまり、鉄の「さび」は、酸化鉄の一種です)。
鉄の酸化は、空気や水にふれると起きやすくなります。
鉄の「さび」には、「赤さび」と「黒さび」の2種類があります。
「赤さび」は、鉄をもろくして、壊れやすくする、やっかいなサビです。
このため、屋外にある鉄でつくられた建築物などは、赤さびを防ぐために、ペンキなどの塗料を塗っています。(※ 2020年代の参考書では、ここまで教える。1990年代では、ここまで教えていなかった。なので、この理科的なしくみを知らない団塊ジュニア世代やバブル世代の大人も多い。)
- ※ 学校のなかにある、適度にさびた建築物や(たとえば金網(かなあみ)など)、あるいは通学路に、公共のさびた建築物などがあれば(古い鉄製の公共の柱とか、金網とか)、教師が例に出して説明すると思います。
建築用の塗料には、ふつう、樹脂などで作られた液体が含まれており、それが建築物の鉄の表面に固着して保護膜となることで、酸化をふせぐ仕組みです。
建築物の塗料は、色がついていますが、けっして単に見た目をキレイにする目的だけではなく、さらに鉄の酸化をふせぐための樹脂がふくまれているのです。
酸化をふせぐには、銅などのほかの金属を使う方法もありますが、しかし強度が足りなかったり、価格面で高くなります。
このため、鉄は、多くの建築材料で用いられている、大切な材料です。
ほか、鉄の場合、ステンレス合金といわれる、鉄以外の元素をまぜた合金によって、さびを発生しづらくした合金もあります。(けっして、まったくサビないわけではなく、サビが進みづらいだけ。なので、たとえステンレス鋼管の水道管だろうが、50年とか放置してるとポキッと折れたりします。)
ペンキ以外の、赤さびを防ぐ方法もあります。
(「赤さび」ではなく)黒さびを表面に形成させる事により、赤さびが生じる事を防ぐという方法もあります。黒さび(Fe3O4)を形成させることで、赤さび Fe2O3を防ぐ方法です。
- ※ 赤さびと黒さびの違いは、1990年代から中学で口頭で教わる。また、2020年代の受験研究社の参考書にも書いてある。
建築物などに使われている鉄を、表面をペンキなどの塗料(とりょう)で、塗装(とそう)する理由のひとつは、酸化をふせぐため である。
鉄が空気と触れ合わなければ、空気中の酸素とも触れ合わないので、その鉄に酸化が起きなくなる。
しかし、塗料そのものが、しだいに空気中の酸素や雨水などと反応して分解したりしていくので、建築物などでは数年ごとなど、定期的にペンキを塗り直す必要がある。
なお、アルミニウムの建築材には、ペンキを塗らないのが普通である。
アルミニウムは、酸化しても、酸化が表面で止まり、その表面の酸化膜が保護膜になることにより、アルミ内部まで酸化がすすみづらいので、ペンキを塗る必要が無い。
- ※ 「鉄さび」と酸化の関係までなら、1990年代からしていた。しかし、塗料による保護の話が、21世紀になってから加わったようである。
- 証拠として、2024年、参考書の旺文社の参考書と、受験研究社の参考書とで、塗料による鉄の酸化防止の話をしている事を確認。2020年代の現代では、ここまで教える。
- アルミニウムや、ペンキの塗りなおしなどの話は、当wikiのオリジナルであり、参考書ではそこまでは説明していない。だが、せっかくだから、これも知っておくのが良いだろう。身の回りのアルミサッシとか見れば、覚えられるでしょ。
アルミニウムと鉱物
[編集]
アルミニウムは、酸素とむすびつきやすい。 アルミニウムの原料であるボーキサイトの主成分は、酸化アルミニウムである。
(※ 参考 :)アルミニウムは酸素との結びつきが強いこともあり、人類がアルミニウムを発見したのは歴史でも遅くて(おそくて)、1800年ごろに人類はアルミニウムの物質を発見した。そして1850年のナポレオン3世のフランスではアルミニウム製の食器が生産されていた。
さて、ルビーは、酸化アルミニウムの結晶に、クロムがすこし混ざったものである。
サファイアは、酸化アルミニウムの結晶に、鉄とチタンがすこし混ざったものである。
ルビーもサファイアも、酸化アルミニウムの結晶に、不純物がまざったものである。
-
サファイアの原石
-
サファイア
-
ルビーの原石
-
ルビー