高校化学 元素と周期表
古典元素と遷移元素
[編集]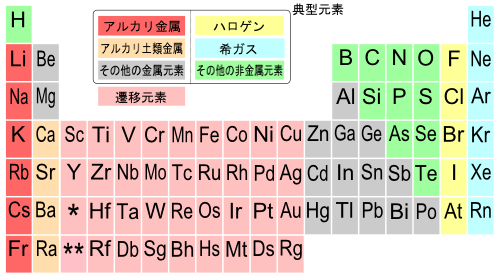
3~12族までの元素を遷移元素、1,2族、13~18族の元素を典型元素という[1]。
典型元素は、1族から順に18族まで価電子数が規則的に変化する。価電子の数は18族は0であり、その他は族番号の1の位と等しい。価電子の数が周期的に変化するため、それに伴って性質も周期的に変化する。したがって、同じ族に属している元素(同族元素)は互いに似た化学的性質を持つ。
典型元素はさらに、それぞれの性質から次のような分類がされる。
一方、遷移元素は価電子数はほとんど変化せず、周期性も見られないが、周期表の隣り合う元素と互いに似た化学的性質を持つことが多い。また、イオンや化合物は有色であることが多いほか、酸化数のとり方が複数あることも特徴である。
典型・遷移元素という分類の他、次のような分類のしかたもある。
- 金属元素: 単体が金属であるもの
- 非金属元素: 単体が非金属であるもの
金属とは、金属光沢があって、展性・延性をもち、電気や熱を伝えやすい性質をもった物質のことであり(→物質と原子)、単体がこの性質をもつ元素を金属元素と呼んでいる。遷移元素はすべて金属元素であり、典型金属に比べて密度が大きく融点が高い傾向にある。金属元素の原子は陽イオンになることが多い。また、単体が金属でない元素を非金属元素と呼び、17・18族はすべて非金属元素である。18族はイオンになりにくく、また1族の水素は陽イオンになることが多いが、その他の非金属元素は陰イオンになることが多い。
周期表と性質の変化
[編集]物質と原子の章で学んだように、元素を原子番号の順に並べた表を周期表と呼ぶ。
周期表の中で、左上の水素と、右上にある典型元素は非金属元素であり、その他中央~左下にかけては金属元素が分布している。ただし、ホウ素やケイ素など、金属元素と非金属元素の境目にあるような物質は、金属と非金属との中間的な性質をもつものが多い。
ある原子から、電子を1個取り去って陽イオンとするために必要なエネルギーを、第1イオン化エネルギーと呼ぶ。これを単にイオン化エネルギーとも呼ぶ。これが小さければ小さいほど陽イオンになりやすく、そのような性質をもった元素を陽性が強いという。また、ある原子の最外殻電子に電子を1つ加えて陰イオンとする時に原子が放出するエネルギーを電子親和力と呼ぶ。これが小さければ小さいほど陽イオンになりやすく、そのような性質をもった元素を陽性が強いという。電子親和力が大きいということは陰イオンの状態の方が安定だから陰イオンになりやすく陰性が強い。
同じ周期の中では、族番号が小さいほどイオン化エネルギーが小さくなる。また、電子親和力は族番号が大きいほど大きくなる。同じ族の中で比較すると、周期が次になるほどイオン化エネルギーは小さくなり、電子親和力は小さくなる。したがって、周期表の中では、右上の元素ほど陰性が強く、左下の元素ほど陽性が強いということがいえる。
