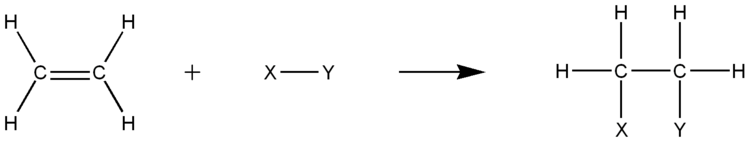高校化学 脂肪族炭化水素
| 分子式 | 名称 | 構造式 |
|---|---|---|
| CH4 | メタン | 
|
| C2H6 | エタン | 
|
| C3H8 | プロパン | 
|
| C4H10 | ブタン | 
|
| C5H12 | ペンタン | 
|
| C6H14 | ヘキサン | 
|
脂肪族炭化水素の内、鎖式炭化水素ですべて単結合な化合物をアルカン、二重結合が一個だけある化合物をアルケン、三重結合が一個だけある化合物をアルキンという。
環式炭化水素ですべて単結合な化合物をシクロアルカンという。
アルカン
[編集]アルカンは分子式がCnH2n+2と書け、不飽和度0である。右におもなアルカンの分子式と名称、構造式を示す。
アルカンが含まれる物質
[編集]天然ガスには、メタン CH4 が含まれる。メタンは天然ガスの主成分である。都市ガスの成分として、メタンは利用されている。
また、ガソリンには、さまざまなアルカンなどの有機化合物が含まれている。
アルカンの立体構造
[編集]メタンは分子式CH4であり、四面体構造をしている。
炭素原子間の単結合と三重結合は自由に回転できるが、二重結合は回転することができない。
したがって、アルカンの炭素間は自由に回転できる。
プロパンの炭素は、折れ線状に、並んでいる。
アルカンの性質
[編集]| 分子式 | 名称 | 沸点 |
|---|---|---|
| CH4 | メタン | -161 ℃ |
| C2H6 | エタン | -9 ℃ |
| C3H8 | プロパン | -42 ℃ |
| C4H10 | ブタン | -1 ℃ |
| C5H12 | ペンタン | 36 ℃ |
| C6H14 | ヘキサン | 69 ℃ |
直鎖のアルカンは、炭素数が増えるにつれて沸点・融点が次第に高くなる。たとえば常温では、炭素数1のメタンから炭素数4のブタンまでは気体であるが、炭素数5のペンタンや炭素数6のヘキサンは液体である。
また、アルカンの炭素数が4以上になると、そのアルカンには構造異性体が存在する。炭素原子数が多くなると異性体の数は爆発的に増加し、たとえば炭素数4のブタンは他に1種類のみ異性体を持つが、炭素数10のデカンは他に74種の異性体を持つ。さらに、炭素数20のエイコサンになると、他に36万種を超える異性体が存在する。
アルカンの性質
[編集]- 水に溶けにくいが、有機溶媒(ジエチルエーテルやトルエンなどが有機溶媒である)によく溶ける。
- ススをほとんど出さずに燃えて、二酸化炭素と水を生じる。
- 固体や液体のアルカンは、水より密度が小さいので、水に浮く。
置換反応
[編集]常温でアルカンは安定であり、薬品と化学反応を起こしにくい。しかし、光を当てると(おもに紫外線による作用で)、アルカンがハロゲン元素と反応して、アルカンの水素原子がハロゲン原子と置き換わってハロゲン化水素を生じる反応が起こる。これを置換反応(substitution reaction)という。
メタン
[編集]
メタンは分子式CH4の、もっとも炭素数が少ない基本的なアルカンである。常温では無色の気体である。実験室では、酢酸ナトリウムと水酸化ナトリウムを混合して加熱することで得られる。なお、この実験では水上置換法で捕集する。
メタンは光を当てるとハロゲンと置換反応を起こす。たとえば、メタンに光を当てながら塩素と反応させると、次のように1つずつ水素が塩素に置き換わる。
- (クロロメタン、塩化メチル)
- (ジクロロメタン、塩化メチレン)
- (トリクロロメタン、クロロホルム)
- (テトラクロロメタン、四塩化炭素)
塩化メチレンは沸点が40℃と分溜しやすいので、有機溶媒としてよく用いられる。サスペンス系の作品において、「クロロホルムを染み込ませた布を口にあてがい、対象を眠らせる」という演出が用いられるが、クロロホルムにそんな作用は存在しない。クロロホルムは粘膜を強く刺激するため、使われた対象は眠るどころか激痛で暴れ回ってしまう。間違っても人に使用しないようにしよう。四塩化炭素はかつて有機溶媒として広く用いられていたが、高い発癌性を持つと判明したため現在は使われていない。
- メタンハイドレート

出典: アメリカ地質調査所。
近年、日本近海の海底など、世界のいくつかの海底の多くの場所の地層中で、氷の結晶中にメタンが存在している事が明らかになった。この海底のメタンの含まれた氷をメタンハイドレートという。採掘されたメタンハイドレートの外見はドライアイスに似ている。採掘されたメタンハイドレートに点火すると、メタンだけが燃え、また、最終的に氷が熱で解けて水になる(氷が燃えてるのではない。燃えてるのはメタンである。)。
将来のエネルギー資源として、メタンハイドレートが注目されている(しかし2016年の現状では、まだ資源として実用的な段階には、メタンハイドレートの利用技術は達してない。)。
なお、メタンは温室効果ガスであるので(メタンの化学式には炭素が含まれているので、燃やすと二酸化炭素が発生するから)、メタンハイドレートを燃やすことでも温室効果があるので、気をつけるべきである。
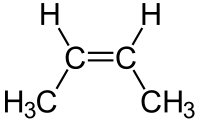
アルケン
[編集]| 分子式 | 名称 | 構造式 | 沸点 |
|---|---|---|---|
| CH2=CH2 | エチレン
(エテン) |

|
-104 ℃ |
| CH2=CHCH3 | プロピレン
(プロペン) |

|
-47 ℃ |
| CH2=CHC2H5 | 1-ブテン | 
|
-6 ℃ |
アルケンは分子式がCnH2nと書け、不飽和度1である。アルケンは不飽和炭化水素である。右におもなアルカンの分子式と名称、構造式を示す。
エチレンの水素原子1個をメチル基 CH3- に置き換えると、プロピレン(プロペン)になる。
エチレン(ethylene)はエテン(ethene)の慣用名である。IUPAC命名法ではエテンであるが、慣用名のエチレンの使用も認められている。
シス-トランス異性体
[編集]アルケンは二重結合が含まれているが、二重結合の部分は回転ができないため、そのため、いくつかのアルケンでは、異性体が存在する。このような異性体を、シス-トランス異性体(cis-trans isomers、幾何異性体)という。
たとえば 2-ブテン では、シス形(cis form)とトランス形(trans form)という2種類の異性体が存在する。
- シス形
cis-2-ブテン
融点:-139 ℃
沸点:4 ℃
- トランス形
trans-2-ブテン
融点:-106 ℃
沸点:1 ℃
付加反応
[編集]アルケンには二重結合が含まれているため、ハロゲンなどと反応して二重結合の1つを切って、そこと単結合をつくる。このような反応を付加反応(additional reaction)という。(反応例を下図に示す。)
たとえばエチレンは、臭素と反応すると、付加反応により、1,2-ジブロモエタンになる。
また、エチレンは、触媒として白金またはニッケルの条件下で、エチレンは水素と付加反応をして、エタンになる。
なお、付加反応はアルケンに限らず不飽和化合物で見られ、炭素間の二重結合や三重結合に対しておこる反応である。一方、アルカンのような単結合のみの飽和炭化水素では起こらない反応である。
- 補:付加反応の仕組み
二重結合や三重結合は、実は異なる2つの結合が同時に起こることで生じる。片方はσ結合(しぐまけつごう)という強い結合で、もう片方は配位結合である。三重結合の場合は配位結合が二重に起こっている。
付加反応においては、この二種の結合のうち弱い方である配位結合が切れることによって付加物が付加する余地が生まれている。
マルコフニコフ則
[編集]
アルケンの二重結合に、HX[注釈 1]が付加するとき、二種類の生成物が考えられるが、このとき、二重結合している炭素原子に結合しているHが多いほうに、HXのHが付加し、少ない方にXが付加した化合物が多く生成する。これをマルコフニコフ則(Markovnikov rule)という。
例えば、プロペンと塩化水素の付加反応では、生成物のうち2クロロプロパンが99%を占める。
酸化
[編集]また、不飽和炭化水素は酸化剤と反応して酸化される。赤紫色の過マンガン酸カリウム水溶液にたとえばエチレンを通じると、エチレンは酸化され、二酸化マンガンの黒色沈殿を生じるとともに赤紫色が消える。このような反応は、メタンをはじめアルカンでは起こらない。
その他
[編集]その他、アルケンは次のような有機化合物一般の性質をもつ。
- 水に溶けにくい。
- エーテルなどの有機溶媒によく溶ける。
- ススを少し出しながら燃えて、二酸化炭素と水を生じる。
エチレン
[編集]
エチレン(ehtylene)は分子式C2H4の、もっとも炭素数が少ない基本的なアルケンである。常温では無色の気体である。二重結合で結びついている炭素原子と、それに直接結合した原子はすべて同一平面上にあるため、右図のようにエチレン分子は全ての原子が同一平面上にある。
エチレンは、実験室ではエタノールの分子内脱水により得られる。エタノールに濃硫酸を加え、160℃程度で加熱するすると、エタノールの分子内で脱水反応がおこり、エチレンが生成する。(下図に例を示す。)※有機化学では濃硫酸を脱水触媒として用いることが多い。
また、エチレンは二重結合を含むため、赤褐色の臭素水に通じると、付加反応により臭素の色が消え無色になる。(下図に例を示す。)
さらに、赤紫色の過マンガン酸カリウム水溶液に通じると、エチレンは酸化され、黒色の二酸化マンガンの沈殿が生じる。
工業的には、ナフサの熱分解でエチレンが得られる。エチレンは様々な薬品の合成原料であり、工業的に重要な物質である。
エチレンは、植物ホルモンでもある。
アルキン
[編集]| 分子式 | 名称 | 構造式 | 沸点 |
|---|---|---|---|
| C2H2 | アセチレン | -74 ℃ | |
| C3H4 | プロピン | 
|
-23 ℃ |
右図のアセチレンのように、一般に、炭素間の結合に三重結合を1つ含むため分子式が CnH2n-2 と書ける炭化水素をアルキン(alkyne)という。右に、おもなアルカンの分子式と名称、構造式を示す。
なお、アセチレン分子の立体構造は、すべての原子が直線上にならぶ配置になっている。この理由は、三重結合の部分は、回転をできないから、である。
アルキンの性質
[編集]アルキンは三重結合のため、付加反応を起こしやすく、酸化剤と反応して酸化される。
また、アルキンは次のような有機化合物一般の性質をもつ。
- 水に溶けにくい。
- エーテルなどの有機溶媒によく溶ける。
- ススを多く出しながら燃えて、二酸化炭素と水を生じる。
燃焼時のススの多さは不飽和度が高いほど多くなり、その時の炎も明るくなる。
アセチレン
[編集]

アセチレンは分子式C2H2の、もっとも炭素数が少ない基本的なアルキンである。アセチレンの構造式は、右図のように HC≡CH と書く。常温ではアセチレンは無色の気体である。三重結合で結びついている炭素原子と、それに直接結合した原子はすべて同一直線上にあるため、右図のようにエチレン分子は全ての原子が一直線上にある。
アセチレンは、実験室では炭化カルシウムCaC2(カルシウムカーバイド)を水と反応させることにより得られる[注釈 2]。炭化カルシウムを細かな穴をあけたアルミ箔で包み、水を入れた水槽に入れると、アセチレンが発生する。アセチレンは水に溶けないため、水上置換法により捕集する。
なお、アセチレンの工業的な製法では、石油などに含まれるアルカンを熱分解(クラッキングという)して、アセチレンをつくる。

アセチレンは、溶接用のバーナーの炎に用いられる。アセチレンに酸素を混ぜて点火すると、3000 ℃を超える高温の炎が得られる。そのため、金属の溶接や切断の際に酸素アセチレン炎が用いられる。
なお、炭化カルシウム のことをカーバイドともいう。しかし、炭化カルシウム以外の物質でも、金属の炭化物のこともカーバイドというので、暗記の必要性は低い。
アセチレンの反応
[編集]付加反応
[編集]三重結合は付加反応を受けやすく、白金やニッケルなどを触媒として水素と反応させると、エチレンやエタンを生じる。
過マンガン酸カリウム水溶液
[編集]塩基性の過マンガン酸カリウム水溶液(赤紫色の状態)に通じると、MnO2の沈殿が生じる。
臭素との反応
[編集]また、アセチレンは三重結合を含むため、赤褐色の臭素水に通じると、付加反応により1-1-2-2-テトラブロモエタンが生じるため臭素の色が消え、無色になる。
水との付加
[編集]硫酸水銀 HgSO4 を触媒として、アセチレンに水が付加することにより、不安定な中間生成物を経て、最終的にアセトアルデヒドを生じる。アセチレンは、まずはじめにビニルアルコール(CH2CH(OH))になるが、これは非常に不安定であり、アセトアルデヒド(CH3CHO)になる。ビニルアルコールはエノール体、アセトアルデヒドはケト体なので、この反応はケトエノール互変異性化と呼ばれる。一般に、ケト体↔︎エノール体の反応において、平衡はケト体側へと偏る。
赤熱した鉄
[編集]アセチレンが、赤熱した鉄にふれると、鉄が触媒として作用し、アセチレンの3分子が重合して、ベンゼンが生じる。
炭素が環状に結合している炭化水素のことを 環式炭化水素という。
シクロアルカン
[編集]| 分子式 | 名称 | 構造式 |
|---|---|---|
| C4H8 | シクロブタン | 
|
| C5H10 | シクロペンタン | 
|
| C6H12 | シクロヘキサン | 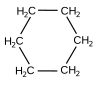
|
一般式CnH2nで表される環式炭化水素をシクロアルカンという。炭素間の結合がすべて単結合である。右におもなシクロアルカンの分子式と名称および構造式を示す。
シクロアルカンの「シクロ(cyclo-)」とは環式であることを表す接頭辞であり、「シクロアルカン」とは環式のアルカンであることを示している。
一般的な性質
[編集]シクロアルカンは飽和炭化水素であり、アルカンに似た性質をもつ。
- 光を当てると置換反応を起こす。
- 水に溶けにくい。
- エーテルなどの有機溶媒によく溶ける。
- 燃えてもススをほとんど出さずに燃えて、二酸化炭素と水を生じる。
シクロヘキサン
[編集]シクロヘキサンは分子式C6H12のシクロアルカンである。分子の構造として次の2種類が存在する。
舟型は不安定な構造であり、通常はいす型の構造をとる。
シクロアルケン
[編集]
環状構造で炭素原子間に二重結合を1個もつ炭化水素を シクロアルケン(cycloalken)という。 一般式はCnH2n-2で表される。
シクロアルケンの化学的性質は、鎖式構造のアルケンに似た性質があり、付加反応を起こしやすい。
シクロアルケンには、シクロペンテンC5H8やシクロヘキセンC6H10などがある。
参考事項
[編集]シクロアルキン
[編集]環状構造で炭素原子間に三重結合を1個もつ炭化水素をシクロアルキン(cycloalkin)という。一般式はCnH2n-4で表される。
炭素数が多く結合に柔軟性がある場合のみ存在し、通常は非常に不安定である。
分子模型セットを持っている人は確かめてほしいが、炭素数が7以下だと三重結合を含む環状構造を作るのがとても難しい。炭素数8ならば歪みがあるものの、辛うじて環状構造を形成することができる。実際、安定して単離されるのはシクロオクチンC8H12である。炭素数10では炭素数8に比べて安定した環状構造を取るが、炭素原子同士の距離が近いので容易に化学反応を起こし、環状構造が壊れてしまう。そのため、シクロアルキンは非常に存在しにくい炭化水素であると言える。
一般に、炭素数が多くなるほど環状構造は不安定になる。
高校化学で考える必要はないが、「シクロアルカンとシクロアルケンはあるけどシクロアルキンは存在しないのか」という疑問を解消するため紹介した。
アルケン以外のシス-トランス異性体
[編集]環状構造の単結合も回転することができないため、環構造を含む化合物はアルケンと同様にシス-トランス異性体が存在する。
また、錯体についてもシス-トランス異性体が存在する場合がある。
この、アルケン以外のシス-トランス異性体は難関大入試では定番のテーマである。