高校化学 電池と電気分解
イオン化傾向
[編集]金属が水または水溶液中で陽イオンになりやすい性質を、イオン化傾向(ionization tendency)という。
亜鉛と銅のイオン化傾向
[編集]硫酸銅(II) 水溶液に亜鉛板を入れると、亜鉛の表面に銅が付着する。これは、亜鉛は銅よりもイオン化傾向が大きいため、 がイオン化し、 の単体が析出したためである。
銅と銀のイオン化傾向
[編集]銅と銀のイオン化傾向を比べるために、硝酸銀の溶液に銅板を入れる。すると、銅板の表面に銀が析出する。いっぽう、銅は陽イオンとなり溶ける。この銅イオンのため溶液はしだいに青くなる。以上の変化を反応式で書くと、
なお、この反応で生じた銀を、生じ方が樹木が伸びるように析出した銀が伸びることから銀樹(ぎんじゅ)という。
また、硫酸銅(II) の溶液に銀板Agをいれても、変化しない。
これらのことから、銅は銀よりもイオン化傾向が大きいことがわかる。
イオン化列
[編集]さまざまな溶液や金属の組み合わせで、イオン化傾向の比較の実験を行った結果、イオン化傾向の大きさが決定された。 イオン化傾向の大きい金属を並べた金属のイオン化列は、以下のようになる。
水素は金属では無いが比較のため、イオン化列に加えられる。金属原子は他にもあるが、高校化学ではこの金属のイオン化列がよく使われる。
語呂合わせとして、
「
がある。
| イオン化列 | K | Ca | Na | Mg | Al | Zn | Fe | Ni | Sn | Pb | (H2) | Cu | Hg | Ag | Pt | Au |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 空気中での反応 | 速やかに酸化 | 表面に酸化皮膜 | 酸化されない。 | |||||||||||||
| 水との反応 | 常温で反応して水素を発生。 | 高温の水蒸気と反応 | 反応しない。 | |||||||||||||
| 酸との反応 | 塩酸、希硫酸と反応して水素を発生する。 | 酸化力の強い酸(など)に溶ける。 | 王水にのみ溶ける。 | |||||||||||||
酸素との反応性
[編集]イオン化傾向の大きい金属の溶解も、酸化の現象も、ともに物質からの電子の放出の現象であるように、一般にイオン化傾向が大きい金属ほど、酸化をされやすい金属である。 実際に、、の純物質の表面は、空気中ではすぐに酸化をして金属光沢を失い、放置すると内部まで酸化をする。
、、、などは、空気中に放置すると、やがて表面に酸化物の皮膜を生じる。酸化物の皮膜の化学式はそれぞれ、 、 、 、、 などである。
水との反応
[編集]水との反応と、イオン化傾向との関係については、アルカリ金属やアルカリ土類金属のK , Ca , Naとは、常温で水と激しく反応し、水酸化物を生じ、また、水素を発生する。
マグネシウム Mg は常温の水とは反応しづらく、沸騰させた水にMgを入れた場合や、高温の水蒸気に Mg を作用させた場合には、反応して水酸化物および水素を発生する。
Al、Zn、Feでは、金属を加熱した状態で、高温の水蒸気を作用させると反応が起こり、酸化物および水素を発生する。反応後の生じる物質は、「水酸化物」では無く、「酸化物」なので注意。
Niおよび、Niよりイオン化傾向の小さい金属は、水とは反応しない。
酸との反応
[編集]一般に、水素よりもイオン化傾向の大きい金属の単体は、希硫酸や塩酸などと反応し、酸のH+を還元するので水素を発生し、金属自身は陽イオンになる。
- Mgと酸
Mgは希塩酸とも強く反応し、水素を生じる。 (KやCaについては、溶媒の水そのものと激しく反応するので、ここでは考察対象から外される。)
- Al,Zn,Feと酸
Al,Zn,Feは希塩酸 や希硫酸 とも反応し、水素を発生する。
- Pbと酸
Pbは希酸とは反応しない。
- Cu,Hg,Agと酸
Cu,Hg,Agは塩酸や希硫酸には溶けない。これらCuとHgとAgは、水素よりもイオン化傾向が小さい。これを溶かす酸には、硝酸か、熱した濃硫酸が必要である。これらの酸( あるいは )は、強い酸化力をもつ。
- (濃硝酸)
- (希硝酸)
- (熱濃硫酸)
これらの反応のとき、水素は発生せず、希硝酸では が発生し、濃硝酸では が発生し、硫酸では二酸化硫黄 が発生する。
電池の仕組み
[編集]二種類の金属単体を電解質水溶液に入れ、極間を導線でつなぐと電池ができる。これはイオン化傾向が大きい金属が電子を放出して陽イオンとなって溶け、電子が導線を伝って、水溶液中のイオン化傾向の小さい金属のイオンが電子を得て析出するためである。
電子の流れ出す側の電極の金属を負極(negative electrode)という。電子を受け取る側の金属の電極を正極(positive electrode)という。
正極と負極の電位差を起電力という。正極で還元される物質を正極活物質、負極で酸化される物質を負極活物質という。
各種電池
[編集]ダニエル電池
[編集]
亜鉛板Znを入れたZnSO4水溶液と、銅板Cuを入れたCuSO4水溶液を、両方の溶液が混ざらないように素焼き板(溶液は混合しないがイオンは通過できる)などで区切った電池をダニエル電池(Daniell cell)という。素焼き板の間をSO42-が亜鉛板側に移動する。CuSO4水溶液は濃く、ZnSO4水溶液は薄い方がよい(Znの溶出が進み、Cuの析出が進む方向)。
陽極(負極)での反応
陰極(正極)での反応
電池式:
起電力:1.1 V
電池式の は負極、 は正極を意味する。また、 は区切りである。 は水溶液であることを示す。
乾電池
[編集]
1.正極端子 2.集電体(炭素棒) 3.負極(亜鉛) 4.正極(二酸化マンガン) 5.電解液(塩化亜鉛・塩化アンモニウム) 6.負極端子
電池の電解液は液体なので、そのままでは持ち運びに不便である。電解液を糊状にして携帯できるようにした電池を乾電池(dry cell)という。
代表的な乾電池にマンガン乾電池(zinc–carbon battery)がある。
- マンガン乾電池
電池式:
起電力:1.5 V
反応式は、負極では亜鉛が以下のように反応して溶け出る。
正極では
炭素棒は電子を媒介するだけで、炭素は反応しない。電子を受け取るのはMnO2である。
二次電池
[編集]ダニエル電池や乾電池は、使用していると、だんだん起電力が低下し、再び電池として使えるようにすることは出来ない。このような電池を一次電池(primary cell)という。充電によって、放電時との逆反応が起こし、繰り返して使用できる電池を蓄電池または二次電池(secondary cell)という。
電池から電流を取り出している状態を放電(discharge)という。
鉛蓄電池
[編集]鉛蓄電池は代表的な二次電池で、自動車のバッテリーなどに利用される。

電池式:
起電力:2.1 V
放電
放電時の反応は、
負極:
正極:
である。放電では、正極と負極の両方に、 が付着する。電解液である硫酸は消費され、硫酸の濃度は低下していく。
- 充電
充電時は放電の逆反応が起こる。
負極:
正極:
鉛蓄電池の反応をまとめると次のようになる。
放電時は、極板の質量が増加し、硫酸の濃度が減少する。
充電時は、極板の質量が減少し、硫酸の濃度が増加する。
燃料電池
[編集]
左側から供給された水素 H2 の一部は、正極でイオン化され、負極にたどり着き、酸素 O2 と反応し水になる。
anode = 陰極 , cathode = 正極 , Fuel = 燃料 , electrolyte = 電解質 .
水素などの陽極の燃料を、触媒を用いてイオン化させ、余った電子を取り出す電池。陽極の燃料が水素の場合は、陰極で酸素および回収した電子と反応し水になる。 様々な方式の燃料電池がある。
リン酸型燃料電池の場合、
電解質にリン酸水溶液を用いている。負極に水素を供給する必要があり、正極に酸素を供給する必要のある電池である。 負極で起きる反応は、
- (負極)
である。負極で生じた水素イオンが電解質を移動し、反対側の正極にまで達し、つぎの反応が起きる。
- (正極)
つまり、水素イオンが酸素によって酸化したわけである。つまり、水素イオンが燃焼したわけである。
この方式の燃料電池の反応式については、高校生はとりあえず、負極で水素が反応して水素イオンが発生することを、覚えておけばよい。そして、正極では酸素と反応して水が生じることを覚えておけばよい。
起電力は約1.2 Vである。このリン酸型燃料電池は、酸素の酸化によって生じたエネルギーの一部を、電気エネルギーにしている装置として、解釈できる。
水の電気分解の、逆の原理であると、解釈してよい。
なお、正極と負極は多孔質になっており、水素や酸素を通過させられるようになっている。
この燃料電池の生成物が水なので、環境にやさしいと考えられおり、開発が進められていて、一部は実用化もしている。
また、反応源の水素を発生するためにも、電気分解などの電力エネルギーなど、なんらかのエネルギーが必要なことから、この電池は、水素のエネルギーを電気エネルギーに変換している装置として、解釈もできる。
アルカリ型燃料電池とは、電解質に水酸化カリウム KOH などを用いる方式である。
他に、固体高分子型や固体酸化物型などがある。
リチウムイオン電池
[編集]リチウムイオン電池は軽く、起電力が大きいので、携帯電話やノートパソコンなどに幅広く利用されている。
- 負極: Liと黒鉛Cの化合物
- 電解液: リチウム塩および有機溶媒
- 正極: コバルト酸リチウム LiCoO2
- 起電力: 約 4 V
- ニ次電池
放電時
負極:
正極:
充電時はこの逆反応が起こる。すなわち、
負極:
正極:
ここで、 は実数である。負極 は黒鉛の中に、リチウム原子が炭素原子と の割合で入っている構造である。リチウム原子は黒鉛の層の間に格納されている層間化合物である。最大で炭素原子6個につき、リチウム原子1個を格納できる。
また、正極のコバルト酸リチウムは、
酸素の層 コバルトの層 酸素の層 リチウムの層 酸素の層 コバルトの層 酸素の層 リチウムの層 ...
という層状の構造である。電解液は炭酸エチレンや炭酸ジメチル、炭酸ジエチルなどの有機溶媒にを溶かしたものが使用される。



※ 参考: その他の実用電池
[編集]実用電池には上述した乾電池や鉛蓄電池の他にも、さまざまな電池があるが、イオン化傾向を利用しているということなどの基本的な仕組みは、あまり変わらない。 その他の実用されている化学電池には、
- アルカリマンガン電池
- 銀電池
- リチウム電池
- ニッケルカドミウム電池
などがある。
| 名称 | 電池の構成 | 起電力 | ||
|---|---|---|---|---|
| 負極 | 電解質 | 正極 | ||
| マンガン電池 | Zn | ZnCl4, NH4Cl | MnO2 | 1.5 V |
| アルカリマンガン乾電池 | Zn | KOH | MnO2 | 1.5 V |
| リチウム電池 | Li | 有機電解質 | MnO2 など | 3.0 V |
| 銀電池 | Zn | KOH | Ag2O | 1.55 V |
| 空気亜鉛電池 (空気電池) |
Zn | KOH | O2 | 1.4 V |
| 名称 | 電池の構成 | 起電力 | ||
|---|---|---|---|---|
| 負極 | 電解質 | 正極 | ||
| 鉛蓄電池 | Pb | H2SO4 | PbO2 | 2.0 V |
| ニッケル・カドミウム電池 | Cd | KOH | NiO(OH) | 1.2 V |
| ニッケル水素電池 | MH (水素吸蔵合金) |
KOH | NiO(OH) | 1.2 V |
| リチウムイオン電池 | Liをふくむ黒鉛 | リチウム塩 | LiCoO2 | 3.7 V |
- アルカリマンガン電池
- 負極: Zn
- 電解液: KOH水溶液
- 正極: MnO2
- 起電力: 1.5V
- 銀電池
- 負極: Zn
- 電解液: KOH水溶液
- 正極: Ag2O
- 起電力: 1.55V
- 一次電池
銀電池は電圧が安定しているため、時計や電子体温計などに用いられる場合が多い。
- リチウム電池
- 負極: Li
- 電解液: LiClO4 および有機溶媒
- 正極: (CF)n
- 起電力: 3.0V
- 一次電池
リチウムは水と反応するので、電解質に水を使うことができない。このため、エチレンカーボネートなどの有機物を電解に用いる。
リチウム電池は長寿命のため、時計や電卓、心臓用ペースメーカなどに用いられている。
- 空気電池
- 一次電池
空気電池は軽量なので、よく補聴器に用いられている。購入時には、空気の侵入をふせぐシールが貼られている。使用し始める際には、シールをはがす。シールをはがすと放電が始まる。はがしたシールを貼り直しても、保存は効かない。
- ニッケルカドミウム電池
- 負極: Cd
- 電解液: KOH水溶液
- 正極: オキシ水酸化ニッケル NiO(OH)
- 起電力: 1.2V
- ニ次電池
ニッケルカドミウム電池は電動工具などによく利用されている。カドミウムの有害性の問題があるので、生産量は減少しており、代替品としてニッケル水素電池に置き換えられていっている。
- ニッケル水素電池
- 負極: 水素吸蔵合金(MH)
- 電解液: KOH水溶液
- 正極: オキシ水酸化ニッケル NiO(OH)
- 起電力: 1.3V
- ニ次電池
負極の水素吸蔵合金は、結晶格子の間に水素を取り込め、必要に応じて取り込んだ水素を放出できる。ニッケル水素電池は自動車のハイブリッドカーのバッテリーに用いられる。なお、水素記号のことを記号でMHと表す場合もある。
ボルタ電池
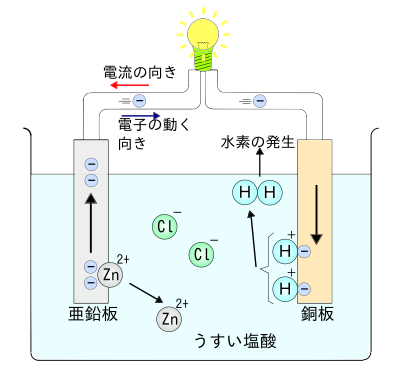
ボルタ電池は教科書では次のような説明がされるが、不正確な部分があるため、定期試験で出題されない限りは、覚える必要はない。
- 希硫酸 H2SO4 の中に亜鉛板Znと銅板Cuを入れたもの。
負極(亜鉛板)での反応
- Zn → Zn2+ + 2e-
正極(銅板)での反応
- 2H + + 2e- → H2↑
起電力
[編集]ボルタの電池では、得られる両極間の電位差は、1.1Vである。起電力は、両電極の金属の組み合わせによって決まる物質固有の値である。
電池と酸化還元との関係
[編集]ボルタの電池の亜鉛板で起きている反応は、電子を放出することから酸化反応である。また銅板で起きている反応は、電子を受けとっているので還元反応である。
電池図
[編集]- (-) Zn | H2SO4aq |Cu (+)
分極
[編集]ボルタ電池では、正極の銅板で発生する水素が銅板を包むので、銅板と溶媒とのあいだの電子の移動が妨げられる分極が起きる。このような分極を防ぐために酸化剤を溶液に加える。この分極を防ぐ目的で加える酸化剤を減極剤という。減極剤としては過酸化水素水 H2O2,またはMnO2,またはPbO2を使用する。
電気分解
[編集]電解質の水溶液に、電極を2本入れて、それぞれの電極に、外部の直流電源から電気を通じると、各電極で水溶液中の物質に化学反応を起こせる。これを電気分解という。
電気分解で、直流電源の負極につないだ側の電極を陰極(カソード)、正極につないだ側の電極を陽極(アノード)という。
陰極では、電源の負極から電子が送られてくるので、陰極では還元反応が起こる。陽極では、電解質から電子が流入するため、酸化反応が起こる。
なお、電気分解の電極には、化学的に安定な白金 Pt や炭素 C などを用いる。
この電気分解は、金属の精錬などに利用されている。
陰イオンのイオン化傾向はである。語呂合わせとして、
がある。
電気分解の反応
[編集]陰極での反応
[編集]水溶液の電気分解では、水溶液中で、もっとも還元されやすい物質が電子を受け取り、還元反応が起こる。
- ・ なので、Cu2+、Ag+などのイオン化傾向の小さい金属イオンが溶けていれば、これらの金属が析出する。
- ・ K2+、Na+などのイオン化傾向の大きい金属イオンしか溶けてない場合、かわりにH2Oが還元されるため水素H2が発生する。
陽極での反応
[編集]電極がPt,Au,炭素の場合、イオン化傾向が OH- より小さい Cl-,I- ,Br- があれば、酸化されてCl2、I2などが発生する。
イオン化傾向が OH- より大きい SO42-、NO3- は酸化されにくいため、かわりにH2Oが還元される酸素O2が発生する。
塩基性溶液では、OH-が酸化されてO2が発生する。
白金や炭素以外の物質を陽極(Cuの場合が多い)にした場合、陽極が酸化されて溶け出す。
塩化銅水溶液の電気分解
[編集]電極には、炭素電極または白金 Pt を用いる。塩化銅CuCl2水溶液では、陰極付近の水溶液では、電源から電子が送られてくるので以下の還元反応が起こり、陰極からは銅が析出する。
- 陰極: Cu + 2e- → Cu
陽極では、電源へ電子が奪われるので、以下の酸化反応が起こり、陽極からは塩素が発生する。
- 陽極: 2Cl- → Cl2 + 2e-
硫酸銅(II)水溶液の電気分解
[編集]電極には、白金 Pt を用いるとする。硫酸銅 CuSO4 水溶液。
- 陰極: Cu2+ + 2e- → Cu
陰極での反応は還元反応である。
- 陽極: 2H2O → O2 + 4H+ + 4e-
陽極での反応は酸化反応である。
この硫酸銅での電気分解の現象は、銅の電気精錬に応用されている。
水の電気分解
[編集]純水な水は電気を通さないので、導電性を高めるために硫酸か水酸化ナトリウムを加える。
- 水酸化ナトリウムを加えた場合
H2とNaのイオン化傾向を比べた場合、Na>H2なので、陰極で還元されるのは水素イオンH+である。
- 陰極: 2H+ + 2e- → H2↑
陰極では、水素H2が発生。
- 陽極: O2が発生。
電気分解の実用例
[編集]水酸化ナトリウムの製造
[編集]工業的な水酸化ナトリウムの製造にはイオン交換膜法が使われている。
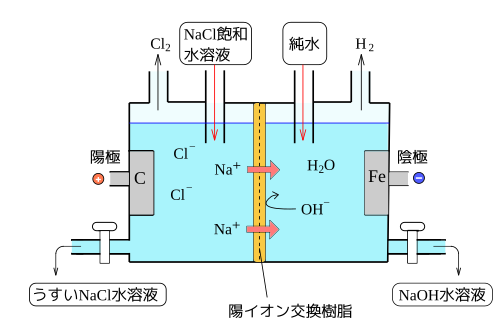
(※ この反応で陰極側に加える液体は、図では「純水」としてあるが、実際は導電性をもたせるために、うすめの水酸化ナトリウムを加える。検定教科書では「純水」と表記してある教科書もあるので、高校生は、気にしなくて良い。)
図のように陽イオン交換膜による隔壁でへだてて片方に陽極、もう片方に陰極の電極を配置する。 そして、陽極側にNaCl水溶液を入れる。電圧をなにも加えて無い状体では、NaイオンとClイオンに分離している。
そして電圧を加えると、電気分解が起きる。
陰極では
- (還元)
陽極では
- (酸化)
という反応が起きる。
その結果、Cl-イオンが発生する。このCl-イオンは陽イオン交換膜を通れず、Cl-イオンはそのまま陽極側にとどまる。そしてCl-イオンは陽極のプラス電荷を受け取って塩素ガスになり気体となって排出される。
いっぽうで、Na+イオンはそのまま水溶液中にとどまり、また陽イオン交換膜を通過する。
いっぽう陰極側ではOH-は陽イオン交換膜を通過できないので、そのまま陰極側にとどまる。また、水素イオンH+は陰極で電荷を受け取り、水素ガスを発生して、排出される。
こうして、陰極側の溶液ではNa+イオンとOH-イオンばかりになる。
Naはイオン化傾向が水よりも大きいので、陰極ではNa+はイオンのままである。なので陰極では水H2Oだけが還元されてOH-ができる。
こうして、陰極ではNaOHの濃度の高い水溶液が得られる。この水溶液を濃縮することによって、水酸化ナトリウムNaOHが得られる。
- 隔膜法
以前は、アスベストなどをもちいた隔膜法(かくまくほう)が用いられていた。この隔膜法も、電気分解を用いる。濃い食塩水(塩化ナトリウム水溶液)を電気分解する方法で水酸化ナトリウムは生産できる。電気分解したときに、塩素の気体が発生するので、気体を排出することにより、溶液中にNa+イオンを多くさせている。
なお、陽イオン交換膜をもちいた方法とは違い、隔膜法の隔膜では塩素イオンも通過してしまうので、この方法では、得られる水溶液に不純物としてNaClが混ざる。
またなお、陽極は炭素Cである。陰極は鉄網Feである。隔膜の外部を鉄網で覆っている。
陽極では
陰極では
という反応が起きる。Naはイオン化傾向が水よりも大きいので、水が還元されてOH-ができる。
陰極で発生したOH-によってNaOHができるが、そのままだと陽極のCl2と反応してしまいNaClになってしまうので、NaとClとを結合させず隔離するために、隔膜としてアスベスト(「石綿」ともいう。)などでつくった多孔質の膜を用いる。アスベストは人体に有害である。
なお、水酸化ナトリウムのことを苛性ソーダ(かせい)ともいう。
銅の精錬
[編集]
銅の鉱石を、コークスCなどとの加熱反応で還元したものは、純度が約99%で、粗銅とよばれる。粗銅には、亜鉛や銀などの不純物が含まれるので、純度をあげためには、不純物を分離する必要があり、そのために電解が利用されている。
硫酸銅(II)水溶液をもちいる。そのさいの電極(陽極)に、純度をあげたい銅を用いる。つまり、粗銅を陽極に用いる。純度の高い銅を陰極に用いる。電気分解により、次の反応が起こる。
- 陰極: Cu2 + 2e- → Cu
- 陽極: Cu → Cu2 + 2e-
陽極からは、銅だけが溶け出すのではなく、イオン化傾向の大きい鉄や亜鉛やニッケルなども溶け出す。しかし陰極で析出するのは、ほとんど銅だけなので、よって陰極にて高純度の銅が得られる、という仕組みである。
粗銅中に含まれている銀や金はイオン化傾向が銅よりも小さいため、陽極の下に沈殿する。これを陽極泥(ようきょくでい、anode slime)という。
陰極には純度の高い純度99.99%程度の銅が析出する。これを純銅という。
融解塩の電解
[編集]アルミニウムやマグネシウムやアルカリ金属やアルカリ土類金属はイオン化傾向が大きいため、そのイオンをふくむ溶液を電気分解しても、アルミニウムなどの単体は得られない。そこで、イオン化傾向の大きい金属を電気分解で得たいときは、塩や酸化物を融解し、これを電気分解することで単体を得る。このような方法を、溶融塩電解(熔融塩電解、ようゆうえん でんかい)または融解塩電解という。
アルミニウムの精錬
[編集]酸化アルミニウムAl2O3の電気分解によって、アルミニウムが得られる。
酸化アルミニウムAl2O3は、鉱石のボーキサイト(Al2O3・nH2O)から、つくられる。そのボーキサイトからの酸化アルミニウムのつくりかたの説明は省略する(検定教科書でも、くわしい説明は省略)。Al2O3は、アルミナとも呼ばれる。
アルミニウムを得たい場合、アルミナAl2O3は融点 2072 °Cと非常に高いため、そのままでは融解させづらい。そこで融点を下げるため、氷晶石Na3 AlF6(融点 1012℃)を、割合が氷晶石9.5重量%ほど加えると、溶融温度が下がり、融点が約970℃になる。これを炭素電極によって電気分解によって、陰極で、アルミニウムができる。
陽極では、電極の炭素が空気中の酸素と反応して、COやCO2ができる。
- (陰極) Al3+ + 3e- → Al
この一連のアルミニウムの電解方法をホール・エルー法(Hall-Héroult process)という。
電気分解と電気量との関係
[編集]単位の定義
[編集]- クーロン
1Aの電流が1秒間、流れこんで貯まったときの電気量を1クーロンという。記号はCである。
電気量をQとすると、電流iで時間t秒の電流を流した場合は、Qとiとtの関係は、
- Q = i × t
である。
- ファラデー定数
1molの電子がもつ電荷をファラデー定数(Faraday constant)という。ファラデー定数 F は
である。
有効数字を三桁とすると、ファラデー定数は F = 96 500 C/mol である。
ファラデーの電気分解の法則
[編集]- 電気分解によって、電極で変化する物質量は、与えた電気量に比例する。
- 電気分解によって、価数の異なる物質の変化を比べた場合、同じ電気量で変化する物質量は物質の価数に反比例する。あるいは物質の(1/価数)に比例する。
この法則を、電気分解におけるファラデーの法則という。
- 例1
AgNO3の電気分解では、電流1Fで物質量1molのAgが析出する。なぜなら、Agは1価であり、反応式は
のように反応するからである。
- 例2
CuSO4の電気分解では、電流1Fで0.5molのCuが析出する。なぜなら、Cuは2価であり、反応式は
のように反応するから、銅を1分子析出させるのに電子が2個必要だからである。
- 例3
H2SO4の電気分解では、電流1Fで0.5molのH2が発生する。反応式は
のように反応するから、水素H2を1分子発生させるのに電子が2個必要だからである。
これ等の例のように、発生物の物質量を求める場合の手順は、
- まず反応式を書いてから、
- その式での、電子eの係数と生成物の係数との比を元に、発生物の物質量を計算する。
というふうに計算する。











































![{\displaystyle \mathrm {Zn^{2+}+4NH_{4}^{+}\rightarrow [Zn(NH_{3})_{4}]^{2+}+4H^{+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e38126052ee1c660b8349933aa52df4bcddd2df7)







![{\displaystyle {\ce {Pb + 2H2SO4 + PbO2 <=>[{discharge}][{charge}] 2PbSO4 + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0260d8c0bb24b6584584ea819131a37096962360)


















