高等学校化学基礎/物質の構成
この項目は、高等学校の化学基礎を学ぶ上で、そのもっとも基本的な考え方である「物質の源泉を探る」というテーマに対して、物質がどのようなものからできているのか、それらによってどう構成されているのか、といった事柄を基本にして、解説を記述したページである。
物質と元素
[編集]化学とは、物質同士の反応を扱った学問であり、その知識によって自然観察の視野を広げることを目標としている。まずその基礎である物質と元素について知ることからはじめよう。
物質とはなにか
[編集]物の呼び方として、物質という言葉がある。物質とは次の二つの事柄を満たすことを言う。
- 一定の空間を占め、質量を有するもの。
- 人間によって認知できるもの。
例えば、プラスチックは物質であり、鉄も物質である。これらは上の事柄を満たす。しかし、虹や映像は物質ではない。虹はあくまで人間の網膜に光が届くことで認識されるものでしかない。映像も、単なる光学現象に過ぎない。物質は、現象ではない。ただし、虹を見せる原因になっている空気中の水滴などは物質である。また、映像を見せるスクリーンやモニターも物質である。同様に、夢や時間といった観念も物質ではない。これは、容易に理解出来得るだろう。人の考えなどによって生み出されたものである観念は、空間を占めないし、質量も持たない。
物質の要素
[編集]| 番号 | 名称 | 元素記号の例 |
|---|---|---|
| 1 | 水素 | H |
| 6 | 炭素 | C |
| 7 | 窒素 | N |
| 8 | 酸素 | O |
| 16 | 硫黄 | S |
| 20 | カルシウム | Ca |
| 26 | 鉄 | Fe |
| 29 | 銅 | Cu |
| 47 | 銀 | Ag |
| 79 | 金 | Au |
これら物質は、元素(Element)と呼ばれる基本要素が組み合わさることでできていることがわかっており、また、原子(atom)という基本構造が組み合わさることによって構成されていることもわかっている。それでは、元素について、基本的な事柄を知ろう。
元素は、現在では118種類見つかっており、それぞれに名前と、原子番号、元素記号が割り当てられている。元素記号はラテン語、英語、ドイツ語の元素名から1文字または2文字を取って表される。一文字目は必ず大文字であり、二文字目は必ず小文字である。後で詳しく述べるが、物質を表す際に、2つ以上の元素記号を並べて書くことがあるので、大文字・小文字を正しく使い分けなければ混乱してしまう。以下に、代表的な元素の元素記号を右の表に記したので、参考にしてほしい。詳しい元素記号の表は、関連項目に掲載しておいた。
物質の分類
[編集]一つの物質がどのような種類の元素の組み合わせになっているか、どのような元素の集まり方によって成立しているか、といったことは当然ながら物質ごとに異なっている。具体的にある物質がどういった元素から組み合わさっているのか、といったことはこれから先で学んでいく。まずは、元素の組み合わさり方から生まれる物質の分類について記述しておく。
単体と化合物
[編集]物質は元素から構成されているが、ある物質が一様な元素のパターンで形作られているとき、それらの物質は単体と化合物に分けることができる。
一種類の元素のみから構成されている物質を単体という。鉄は鉄元素のみからなる単体であり、水素は水素元素のみからなる単体である。ダイヤモンドも、炭素元素が結びついた単体である。炭素の単体には黒鉛やフラーレンなどが存在する。鉄や銅、水素、酸素、窒素など、代表的な単体が存在する元素は、その単体の名前が元素名になっていることがある。
単体に対して、二種類以上の元素から構成されている物質を化合物という。水(H2O)はH元素とO元素からなる分子から構成されている化合物である。他にも、酸化銅II(CuO)や、塩化アルミニウム(AlCl3)など、多くの種類がある。これらの言葉は、物質を、その要素となる元素の集まり方に着目して分類している。単体か化合物か、どちらかに属する物質を純物質というが、この言葉については後述する。
単体は、ひとつの元素によって構成されている物質を言うが、単体に属する物質の中には、同じ元素から成る単体であってもその性質が異なる場合がある。これらを互いに同素体(allotrope)という。イメージでとらえるのなら、同じ組木細工を使った工作品でも、組み合わせ方によって大きく形が変わることがある様に、元素の組み合わさり方によって物質全体の形が大きく変わることがある、ということである。
主な同素体は次の表の通りである。
| 元素 | そのおもな同素体 | 身近な例 |
|---|---|---|
| 硫黄 S | 斜方硫黄 | 斜方晶系と呼ばれる形の結晶になっている硫黄。数十年という長い時間をかけて結晶化する |
| 単斜硫黄 | 斜方晶系と同じく、単射晶系と呼ばれる形の結晶になっている硫黄。数分から数秒で結晶化した場合は、この形になる | |
| ゴム状硫黄 | 加熱して溶けた硫黄を水の中に流し込むなどして瞬間的に凝固させた硫黄。ゴムみたいな性質をもつ | |
| 炭素 C | 黒鉛 | 鉛筆の芯 |
| ダイヤモンド | モース硬度の高さが有名 | |
| 酸素 O | 酸素 | 大気中に多く存在する |
| オゾン | 成層圏のオゾン層に多く存在する | |
| リン P | 黄リン | 自然発火する |
| 赤リン | マッチ箱の側面に使われる |
この表にあげた同素体を持つ4つの元素 S, C, O, P はSCOP(スコップ)と覚えられることがある。
-
黒鉛
-
ダイヤモンド
炭素の同位体には、上表で上述した以外にも、フラーレンやカーボンナノチューブなどが知られている。
-
フラーレンC60 の球棒モデル
-
カーボンナノチューブの幾何学構造図。アームチェアチューブ、ジグザグチューブ、カイラルチューブの3種類に分けられる。
純物質と混合物
[編集]- 純物質
- 物質が単体か一種類の化合物であるとき、その物質を純物質(pure substance)と呼ぶ。
純物質は、物理的操作(叩く、引っ張る、ろ過する、といった操作)によってそれよりも小さい構成パターンに分けることができないようなパターンの集まりだと考えられる。ここで言うパターンとは、元素の組み合わせのことである。単体や化合物は、物理的な操作だけではその構成を変えることができない。例えば、水は蒸発させても凍らせても叩いてもろ過しても、水のままである。しかし、電気分解を行うことで水素と酸素に分解できることは、中学校で学習した通りだ。具体的には、前者を物理的操作、後者を化学的操作と呼ぶ。
- 混合物
- 純物質に対して、物理的操作によって分類できる可能性がある物質を、混合物(mixture)と言う。
混合物は、単体や化合物が混ざり合っている物質である。液体や気体が容易に想像できるが、固体にも混合物は多く存在する。多くの岩石は混合物である。火成岩にさまざまな鉱石が含まれていることは中学校で学習したことであろう。鉱石ひとつひとつは、一部には不純物が含まれることはあるものの基本的には純物質であり、それらが集まってできている火成岩は混合物である。ほかにも、塩酸は塩化水素(HCl)と水(H2O)の混合物であるなど、混合物は非常に多い。
純物質と混合物の分類の定義自体に対しては、直観的な理解をしていればかまわない。しかし、ある物質が純物質か混合物かということはしっかりと把握する必要がある。
物質の構成による分類
[編集]これまでに学習した単体、化合物、混合物についてまとめた。右側には具体例となる物質を挙げたので、参考にしてほしい。
| 物質の構成 | 具体例 | ||
|---|---|---|---|
| 物質 | 純物質 | 単体 | 鉄(Fe)、水素(H2)、酸素(O2)、など |
| 化合物 | 水(H2O)、酸化銅(II)(CuO)、など | ||
| 混合物 | 食塩水(水と塩化ナトリウム)、海水、空気、岩石など | ||
物質を構成する原子
[編集]物質は元素から成り立っている。この、元素というものは、物質を構成する物の性質について言った言葉である。したがって、実際の「物質を構成している最少の粒」を言うものと元素とでは、言葉の意味が異なってくる。物質は原子という構造によって構成されており、元素という要素によって成立している。
物質は、原子( Atom )と呼ばれる、小さないくつかの粒子(これらを素粒子と呼ぶ)が集まった構造を持つ粒で構成されている。物質は原子という小さな構造から作られていると考えることができる。
- 原子
- 物質を構成する基礎的な構造を持った粒子。
原子が物質を構成する粒子であるのに対し、元素は物質がどんな性質のものの集まりであるかを示す。「水は水素元素と酸素元素からできている」というのは「水が水素という基本要素と酸素という基本要素から成り立っている」という意味である。この、基本要素とは原子の集合のことでもあるため、元素と原子は非常に意味が似ている。
意味が似ている上に、日本語では音が似ていることもあり、しばしば混同されるが、両者はまったく別の概念であり、英語にすると元素は「element」、原子は「atom」と、まったく異なる単語である。元素は世界を形作る要素のことであり、原子はそれ以上分割できない最小の単位である。元素は構成しているものの種類のようなものを指すのに対し、原子はそれ自体分類の意味を含まず、単に最小の粒の意味にとどまっている。これが、元素と原子の意味の違いである。
実際には、元素は原子の種類を表す語であるという認識が普通である。また、発見当初は最小単位だと思われていた原子は、素粒子と呼ばれるさらに小さな粒から出来上がっていて、最小の単位ではないことがわかっている。しかし、通常の化学反応や物質の性質を見ていく中で、素粒子のことまで考える必要はないので、ここでは扱わない。原子がどのような構造をしているかということについては、次のセクションで解説していく。
高等学校では、素粒子については高等学校理科 物理IIで扱う。
この、原子と元素の言葉の違いについては、できるだけしっかりと理解しておくことができれば、後々の内容で混乱しないと思われる。どうしてもイメージがつかめないのなら、読み飛ばしてもかまわない。
基本的に、原子がいくつか結びつきあうことで分子が生じ、原子や分子が電荷をもつことでイオンが生じる。これらの語について簡単に説明しておく。この、分子やイオンも、物質を構成する単位であるが、詳しくは後述する。
- 分子
- 分子は複数の原子が結びついた、原子と比較して大きな粒。
- イオン
- イオンは、原子や分子がある条件のもとで電荷を持った粒。
原子の構造
[編集]原子とは、物質を構成する粒子一粒の呼び名である。膨大な数の原子が相互に結び付きあって、私たちの体や、他の様々なものは形作られている。原子そのものも、素粒子と呼ばれる粒が構造的に結びついて構成されているが、化学では、原子を基本単位としてその性質を分析していく。
元素と原子の違いについては物質を構成する実体を参照。
原子はあまりに小さいため、特殊な電子顕微鏡などを用いなければ観察することができない。その直径は約100億分の1メートル( 1×10-10m = 0.1nm )である。つまり、原子をだいたい1億個くらい並べればやっと1cmである。原子がどれほど小さいか、想像することができるだろうか?
原子の基本構造
[編集]
原子は、中心にある原子核(atomic nucleus)と、その周り(電子殻、electron shell)を飛び回るいくつかの電子(electron,図では黄色)の構造である。原子の構造は簡単には説明できないが、高等学校の化学においては一般的に、ボーアの原子模型と呼ばれるモデルを使って理解する。右に示した図は、ヘリウム原子(He)のボーアモデルである。ボーアモデルでは、原子の化学的な性質を全て説明することはできない。その意味でこのモデルは不十分ではあるが、高等学校の化学の範囲ではこのモデルでも十分にイメージをつかめる内容を扱っているため、紹介した。原子の構造について記述するときは、基本的にこのモデルを用いて行う。
まず、原子の構造の要素である原子核と、陽子・中性子・電子について知ろう。これらは高等学校化学で扱う最も小さな粒である。
- 原子核(atomic nucleus)
- 陽子と中性子の塊である。正の電荷を持っている。
- 陽子(proton)
- 原子核を構成する素粒子の一つ。陽子一粒が、+eの電荷を持っている。
- 中性子(neutron)
- 原子核を構成する素粒子の一つ。ただし、中性子だけでは原子核にはならない。電荷は0である。
- 電子(electron)
- 原子核の周りを回る軽い粒子。-eの電荷を持っている。
右に示した図で言えば、真ん中の赤い粒が陽子、おなじく真ん中の黄緑色の粒が中性子。それから、周りにある黄色い粒が電子である。全ての原子は、このような「原子核の周りに電子」という構造をしていると考えられている。
考えられている、というのは、原子があまりに小さく、直接観察することができないためである。科学者がさまざまな実験・考察を積み重ね、それらを総合的に判断した結果、「原子は中心に原子核、周囲には電子という構造をしている」ととらえるのが最も妥当だと考えられている。このことについては、ウィキペディアの「原子」項の「歴史」セクションやラザフォード散乱に記事があるので、興味のある人は参考にすると良いだろう。
電子殻と価電子
[編集]

原子の構造のうち、電子が並んでいる原子核の周りの部分について、より詳しく見ていこう。
- 電子殻(electron shell)
- 電子が飛び回っている部分全体を指す。階層構造になっている。
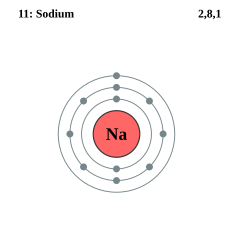
この電子殻は何重かにわかれており、内側からK殻(K shell)、L殻(L shell)、M殻(M shell)、……と呼ぶ。基本的に電子は内側の電子殻から入っていく。それぞれの層に入ることのできる電子の数は決まっており、その数以上の電子が一つの層に入ることは無い。たとえば、K殻に入ることのできる電子の数は2つまでである。内側から数えてn番目の電子殻に入ることのできる電子の数は、2n2個である。
また、いちばん外側の電子殻にある電子を最外殻電子と呼ぶ。最外殻電子は化学反応などにおいて重要な役割を担うため原子の性質に大きな影響を与える。ある原子とある原子との接点が、実際には最も外側の電子殻であるため、原子の結合にはこの最外殻電子の個数が重要になってくる。原子の性質を決める最外殻電子を特別に価電子(valence electron)と呼ぶ。 最外殻にそれ以上電子が入ることのできない状態を閉殻という。閉殻になっている原子の価電子の個数は0であると約束する。

各々の原子の電子の、電子殻への配列の仕方を電子配置 (electron configuration)という。K殻に2個の電子が全て収められた場合の電子配置は、希ガスであるヘリウムHeの電子配置と同じである。L殻まで電子が全て収められ、L殻に8個の電子とK殻に2個の電子の合計10個の電子が全て収められた場合の電子配置は、希ガスであるネオンNeの電子配置と同じである。 同様に、M殻の終わりまで全て電子が収められた状態は、希ガスであるアルゴンArの電子配置と同じである。
-
ナトリウム原子Naの電子は、K殻に2個の電子。L殻に8個の電子。M殻に1個の価電子を持つ。
-
塩素原子Clの電子は、K殻に2個の電子。L殻に8個の電子。M殻に7個の価電子を持つ。
電荷
[編集]原子の構造を理解する助けとして、これから先になって必要になってくる概念である電荷という言葉については、ここで簡単な説明を加えておく。
- 電荷(electric charge)
- 粒子にある電気的な性質のこと。プラスの量とマイナスの量があり、当然ながら0も存在する。
この電荷という概念は、高等学校物理などでも扱う。電荷を持った粒子がどのような振る舞いをするかについて興味を持ったなら、そちらを参考にすると良い。
電荷を持った粒子は基本的に次の性質を持っている。これらを知っていれば、高等学校の化学においては十分であろう。
- 同じ符号の電荷を持った粒子同士は反発する力が働く。
- 逆の符号の電荷を持った粒子同士は引き合う力が働く。
- 電荷を持った粒子同士に働く力は、距離が近いほど大きくなる。
ある原子核に陽子が3つ含まれているとき、原子核全体の電荷は
- +e × 3 = +3e
と表される。さらに、この原子核の周りに電子が3つ回っているならば、原子全体の電荷は、
- (+3e) + (-3e) = 0
となる。これは、原子全体では電荷を持っていないということである。このことがらを利用すれば、原子全体の電荷や、原子の名称などから、それにいくつの陽子や電子が含まれているかを計算することができる。
原子に関する諸概念
[編集]原子の分類
[編集]原子の性質は、その原子の原子核に含まれる陽子の数で決まる。これは、原子の性質そのものが、電子や周囲の原子に対してどのように結びつきあうか、ということと同じであるからだ。プラスの電荷はしりぞけあうため、原子核同士は容易に衝突はしない。しかし、電子は原子核に引き寄せられる。電荷が0の原子と電荷が+eの原子があれば、電子は-eの電荷を持っているので、+eの電荷を持つ原子に引き寄せられる。といった具合である。
実は、元素の分類、つまり原子がどの元素に属するかという判断は、その原子の原子核に含まれる陽子の数によって行われている。例えば、水素(H)に属する原子の場合、それに含まれる陽子の数は必ず1個である。同じように、炭素(C)に属する原子の原子核には、必ず6個の陽子が含まれている。逆に、ある原子の原子核に陽子が6個含まれるなら、その原子は炭素である。
このように、ある原子の原子核に含まれる陽子の数がわかれば、その原子がどの元素に属するかも分かる。逆に、ある原子がどの元素に属するのかがわかれば、その原子の原子核に含まれる陽子の数がわかる。よって、ひとつひとつの元素に分類される原子について、そこに属する原子の陽子の数を元に番号を付けることができる。こうしてつけられた番号を、原子番号(atomic number)と呼ぶ。原子番号は 6C のように、原子の左下に小さく書いて示す。原子番号は多くの場合において省略される。
炭素に属する原子を炭素原子、あるいは単に炭素などと呼ぶ。よって、「炭素」という言葉が元素としての炭素を指し示す場合もあれば、原子一粒としての炭素を指し示す場合もある。一般的には、炭素と言えば原子の方を指す。これは、元素と原子が同一視されやすい原因の一つである。さらにいえば、元素の項目で解説した番号とは、この原子番号を指す。元素の番号は、その元素に属する原子の原子核に含まれる陽子の数と一致する。元素記号も、多くの場合では、原子の分類を示す時に用いられる。
| 原子番号と元素記号と陽子の数の対応の例 | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| ||||||||||||||||||||||||||||||||
原子の質量
[編集]原子は陽子、中性子、電子から構成されているため、これらの粒子の質量の総和が、原子全体の質量になる。電子の質量はとても小さい(陽子の1/1836。9.1093826×10−31kg)が、陽子の質量は1.67262×10-27gで、中性子も大体同じくらいの質量を持っている。しかし、このような桁の多い数字をいちいち用いて計算するのは無駄手間である。幸い、陽子と中性子はほぼ同じ質量であり、また電子の質量はそれと比べて無視できるほど小さいので、原子全体の質量は、おおざっぱには陽子と中性子の数の和で表す事ができる。これを質量数 (mass number) と呼ぶ。質量数は 12C のように、原子の左上に小さく書いて示す。
- 質量数 (mass number)
- ある原子の原子核に含まれる陽子の数と中性子の数の和。
- 質量数をM、元素記号をXとすると、MX のように書き表す。
質量数はあくまで、陽子と中性子の個数の和であり、質量そのものではないことに注意が必要である。さらに言えば、これら質量数はあくまで指標であり、実際の質量は厳密には異なってくる。また、ある質量数の原子の個数と実際の質量との関係については、物質量と化学反応式のページで解説していくことになる。
具体的には、ある原子の質量数が16で、その原子に中性子が8個含まれている場合、
- 16 ( 質量数 ) - 8 ( 中性子の数 ) = 8 ( 陽子の数 )
より、8個の陽子が含まれていることが分かる。8個の陽子が含まれている原子は、酸素(O)である。
- 同位体
ある二つの原子について、原子番号が同じでも質量数が異なることがある。言い換えると、原子番号は陽子の数であるため、陽子の数が同じ二つの原子であっても、その原子核に含まれる中性子の数が違うことがある。 このような、同じ元素でも質量数のことなる原子を互いに同位体(isotope)と呼ぶ。あるいはアイソトープと呼ぶ。 なお、「同位体」という名前が「同素体」と似ているが、異なる概念なので混同しないように読者は注意のこと。
炭素Cの代表的な同位体には、12C と13C がある。
炭素Cの同位体には14Cも存在する場合もあるが、この14Cは不安定であり、すぐに崩壊して質量数が変わってしまう。原子核が壊れるとき、一般に放射線をだすので、不安定な同位体が壊れたときも放射線を出す。14Cも崩壊するときに放射線を出す。 14Cのような、すぐに崩壊して放射線を出す同位体を放射性同位体(ラジオアイソトープ,radioisotope)という。 これに対して安定して存在できる同位体を安定同位体(stable Isotope)という。
同位体であっても、安定な同位体の化学的な性質は、ほとんど等しい。なぜなら、それらの原子核に含まれる陽子の数が同じだからである。
他の多くの元素にも同位体は存在する。 たとえば水素Hには、自然界には1H と2Hがある。1Hの存在比率は、およそ99.98%である。2Hの存在比率は、およそ0.02%である。質量数2の水素2Hのことを重水素(じゅうすいそ)あるいはジュウテリウム(deuterium)という。 原子力発電所の原子炉内では、質量数3の水素3Hも存在する。この水素3Hをトリチウム(tritium)という。3Hは放射性同位体である。
なお、すべての元素に、自然界で同位体が存在するわけではない。 Be,F,Na,Al,P,Sc,Mnなどには、天然には同位体は存在しない。
周期表と周期律
[編集]
元素を原子番号の順に並べると、性質のよく似た元素が周期的に現れることがある(例:1価の陽イオン(→高等学校化学Ⅱ/化学結合)になりやすい物質……3Li、11Na、19K、など。ここまでは8個間隔で現れている)。このことを元素の周期律(periodic law)という。また、図のような表を、周期表(periodic table)という。
元素を原子番号の順に並べて、かつ周期律に併せて配列した表を周期表という。周期表の縦の列を族(group)といい、同族内では性質のよく似た元素が並ぶ。周期表の横の列を周期(period)と呼び、周期の番号は電子殻の数と一致する。
「族」は、1族から18族までの、合計18個がある。「周期」は、1族から7族までが、現在(2013年に本文を執筆。)では確認されている。 具体例をいくつか挙げると、族については、水素HとリチウムLiとナトリウムNaとカリウムKは、ともに1族の元素である。周期に関しては、水素Hは第一周期であり、リチウムLiは第二周期であり、Naは第三周期である。 他の族の元素でも、例を挙げる。酸素Oは、16族で第二周期の元素である。炭素Cは14族で第2周期である。塩素Clは17族元素で第3周期である。
族が同じ元素どうしを同族元素という。たとえば、HとLiとNaとKとルビジウムRbとセシウムCsとフランシウムFrとは、お互いに同族元素である。 他の族でも例を挙げれば、14族の炭素Cと,シリコンSi,ゲルマニウムGeと,すずSnと,鉛Pbとは、お互いに同族元素である。
- アルカリ金属
1族の同族元素のうち、水素Hを除いた残りの元素の、LiとNaとKとルビジウムRbとセシウムCsとフランシウムFrを、アルカリ金属(alkali metals)という。Hはアルカリ金属には含めない。
- アルカリ土類金属
2族元素のうち、ベリリウムBeとマグネシウムMgを除いた残りの元素の、カルシウムCa,ストロンチウムSr,バリウムBa,ラジウムRaをアルカリ土類金属(alkaline earth metal)という。ベリリウムBeとマグネシウムMgはアルカリ土類金属には含めない。
- ハロゲン元素
17族の元素のフッ素F,塩素Cl,臭素Br,ヨウ素I,アスタチンAtをハロゲン元素(halogen)という。
- 希ガス元素
18族のヘリウムHe,ネオンNe,アルゴンAr,クリプトンKr,キセノンXe,ラドンRnを希ガス元素(rare gas)という。
- 遷移金属
3族から11族の元素を遷移金属(せんいきんぞく,transition metals)という。 遷移金属は、価電子の数が1個または2個であることが多く、族と価電子数が一致しない。
- 典型元素
遷移金属以外の元素である元素はどうだろうか。1族と2族と12族~18族の元素を典型元素(main group element)という。典型元素では、族の番号の1の位の数が、最外殻電子の数と一致する。
1族の元素と2族の元素は陽イオンになりやすい。 17族の元素は陰イオンになりやすい。 18族の元素は化合物をつくりづらい。天然には単分子で存在するのが一般である。
なお、原子番号、核子の個数をa,bとすればその原子をAの様に書く事がある。
分子とイオン
[編集]物質は、元素という成分から成り立っていることは前述の通りである。しかし、物質が原子という小さな構造によって構成されているという側面もある。そこで、原子同士がどのような構造を形成して物質が形作られているのか、といった視点から物質を分けることもできる。高等学校化学では主に、イオンからなる物質、分子からなる物質、原子からなる物質の三種類を考える。
これらの物質に関して理解する前に、まずは物質を構成する原子の異なった姿である分子・イオンについて知ろう。
分子
[編集]| 様々な分子のモデル |
|---|
 |
 |
 |
 |
- 分子
- 分子とは、物質としての性質を持った最小単位の一つである。
- 1つ以上の原子から成り立っている。
分子は電気的に中性であるため、これらが物理的に運動する限りにおいては、電磁気の問題は基本的に発生しない。 一般に分子は原子が複数個集まってできていることが多いが、ただ一つの原子だけで独立して分子となるものもいる。希ガスと呼ばれる種類の原子は、他の原子と結びつかず、独立で分子を構成する。
- 単原子分子(monoatomic molecule)
- 一個の原子から構成されている分子。具体的にはヘリウムHeやネオンNeなど。
- 多原子分子(polyatomic molecule)
- 二個以上の原子から構成されている分子。たとえば水H2Oや酸素O2など。
ある分子が、どのように原子が結びついて出来ているのかということを表記するとき、一般的には分子式を用いる。
以下に、様々な分子の例を示した。また、それらの分子式も付け加えた。分子名はウィキペディアのそれぞれの分子の項目にリンクしているので、より詳しい性質を見たい人は参考にすると良い。
| 名称 | 分子式 | 分類 | 簡単な性質 |
|---|---|---|---|
| 水素 | H2 | 多原子分子 | 常温で気体。 |
| 酸素 | O2 | 多原子分子 | 常温で気体。物を燃やす働きがある。大気の約21%がこの分子である。 |
| 窒素 | N2 | 多原子分子 | 常温で気体。大気の約78%がこの分子である。 |
| 水 | H2O | 多原子分子 | 常温で液体だが、固体や気体の姿もおなじみだろう。 |
| アンモニア | NH3 | 多原子分子 | 刺激臭。水によく溶け、水溶液はアルカリ性を示す。 |
| 二酸化炭素 | CO2 | 多原子分子 | 常温で気体。 |
| ネオン | Ne | 単原子分子 | 希ガスの一種。ネオンサインなどに利用される。 |
| アルゴン | Ar | 単原子分子 | 希ガスの一種。大気の約1%がこの分子である。 |
イオン
[編集]| 様々なイオンのモデル |
|---|
 |
 |
 |
 |
最外殻電子に含まれる電子の数が8個(K殻のみ2個)である状態を閉殻構造と呼ぶ。原子は、電子を受け取ったり、他の原子に電子を渡したりして、閉殻構造を作ろうとする。これは、閉殻構造が非常に安定した形であるためだと考えられている。原子は通常の状態であれば電荷的に中性だが、このように電子を渡したり受け取ったりして粒子全体として電荷をもつことがある。このように、電荷を持った粒子のことをイオン(ion)という。特に正の電荷を持つ粒子を陽イオン(positive ion)と言い、負の電荷を持つ粒子を陰イオン(negative ion)と言う。
- 陽イオン(positive ion)
- 正の電荷を持ったイオン。
- 陰イオン(negative ion)
- 負の電荷を持ったイオン。
価電子の少ない原子は、電子を失って陽イオンになりやすい。逆に価電子の多い原子は、電子を受け取って陰イオンになりやすい。このように失ったり受け取ったりした電子の数を、そのイオンの価数(valence)という。価数が1のときそのイオンは1価であるといい、以下2価、3価と数える。電子の電荷は-eであるが、ここでは、電子一つを基準にしていることに注意。
左の図はナトリウム原子(Na)のボーアモデルである。ナトリウムの原子番号は11であるため、K殻に2個、L殻に8個、M殻に1個の電子が含まれる。電子が11個あり、この時点では原子核の電荷+11eと電子の電荷-11eが相殺し合って、原子全体としては電荷的に中性である。しかし、価電子数が1で、閉殻構造を取れていない。右の図は塩素(Cl)のボーアモデルである。塩素の原子番号は17であるため、K殻に2個、L殻に8個、M殻に7個の電子が含まれる。これもやはり電荷的に中性であるが、閉殻構造を取れていない。最外殻電子の数、すなわち価電子数は7である。
そこで、この二つの原子がある条件下でお互いに電子を受け渡すことが起こる。上の図は、最外殻電子のみを描いたボーアモデルで、電子の受け渡しを表現したものである。ナトリウム原子は原子核の+11eと、ひとつ数の少なくなった電子による-10eで、全体として+eの電荷をもっていることになる。塩素は、ナトリウムから電子を一つ受け取って、全体で電子が一つ多いので、-eの電荷をもっていることになる。イオンは普通、このようにして作られると考えられている。また、NaCl全体で見れば電荷的に中性であり、ナトリウムイオンも、塩化物イオンも、ともに閉殻構造を取っている。
イオンとなった原子は、その元素記号の右上に価数と符号をつけることで表現する。このような表現法をイオン式という。
- Mg2+:2価の陽イオンとなったマグネシウム
これは、2価の陽イオンとなったマグネシウムをイオン式で表現したものである。数字が先に来ることにも注意したい。また、+1や-1のときには、数字は書かずに符号のみを付けることになっている。
- H+:水素イオン
イオンは必ずしも一つの原子からなるわけではない。原子がいくつか集まった原子団( もしくは、分子 )でも、様々な理由からイオンになる。
- 単原子イオン
- 原子一粒が電子を受け取ったり渡したりしてイオンになったもの。
- 多原子イオン
- 二個以上の原子が結合した原子団に、電子が結合したり、取れたりしてできたもの。
- NH4+:アンモニウムイオン
- OH-:水酸化物イオン
一般的に、陽イオンは「~イオン」、陰イオンは「~化物イオン」と呼ばれる。また、多原子イオンであれば、それがイオンになる前の分子の名前に「~イオン」や「~化物イオン」と付けて呼ばれることが多い。上述の例で言うなら、アンモニアのイオンはアンモニウムイオンである。
物質の構成
[編集]これまでに学習してきた原子・分子・イオンという粒を使って、実際の物質がどのように構成されているかを見て行こう。このセクションの多くは具体的な物質の紹介になっている。ウィキペディアへのリンクも付けているので、参考にしてほしい。分子の名称は、一般的に用いられているものを示した。ここで挙げた以外の名称で呼ばれる物質もあるため、注意が必要である。
分子からなる物質
[編集]
分子は基本的に独立した一粒である。身近な例を挙げるなら、水や多くの気体などの構成単位は、分子である。分子が構成単位になっている結晶( 固体 )を分子結晶(molecular crystal)という。分子結晶は融点・沸点が低く、やわらかい。また電気を通さない。ずっと拡大すると、分子が規則正しく並んでいるのも、分子結晶の特徴である。
| 物質の名前 | 分類 | 分子式 | 簡単な性質 |
|---|---|---|---|
| 水 | 化合物 | H2O | イオンからなる物質を溶かす。氷は分子結晶である。 |
| ブドウ糖 | 化合物 | C6H12O6 | ショ糖(いわゆる砂糖)の成分。 |
| ドライアイス | 化合物 | CO2 | 二酸化炭素の固体。温度があがると、液体にならずに一気に気体になる。 |
水は、実際には不純物を含んでいることが多い。純粋な水は天然には存在しない。
イオンからなる物質
[編集]NaCl(塩化ナトリウム)という化合物は、ナトリウムイオンNa+と塩化物イオンCl-がお互いに偏った電荷を補い合おうとして結合する。このようにイオン同士がひきつけあってできた結合をイオン結合(ionic bond)という。また、イオン結合によってできた固体をイオン結晶(ionic crystal)という。イオン結晶は融点・沸点が高く、硬いがもろい。これらは基本的にイオンが並んで出来ており、水に解ければ簡単にそれぞれのイオンに分かれる。そのため、固体のときは電気を通さないが、液体あるいは水に溶解した状態では電気をよく通すという性質を持っている。
| 物質の名前 | 分類 | 組成式 | 簡単な性質 |
|---|---|---|---|
| 食塩 | 化合物 | NaCl | 塩酸と水酸化ナトリウムを中和して得られる。 |
| 酸化銅 | 化合物 | CuO | 銅を燃やすと得られる。水素と反応する。 |
原子からなる物質
[編集]原子からなる物質には、自由電子を共有する金属結合によってできるものと、共有結合によってできるものとがある。金属結合によってできた物質は金属光沢を持ち、熱や電気をよく通し、展性( たたくと広がる性質 )・延性( 引っ張ると延びる性質 )を持つ。また共有結合によってできた物質は硬く、融点が高い。例えば、ダイヤモンドは炭素原子が共有結合してできた物質である。
| 物質の名前 | 分類 | 組成式 | 簡単な性質 |
|---|---|---|---|
| 鉄 | 単体 | Fe | 身近な金属。 |
| 銅 | 単体 | Cu | 身近な金属。10円玉の材料。 |
| 銀 | 単体 | Ag | よく知られている金属。電気をよく通す。 |
| 金 | 単体 | Au | よく知られている金属で、最上級のものをあらわすことに用いられる。金メダルなど。 |
| ダイヤモンド | 単体 | C | 最も硬い鉱物。 |
このセクションで用いられた「共有結合」「イオン結合」「金属結合」に関しては、詳しくは粒子の結合で扱う。そのため、ここではそのような種類がある、という理解に留めておいてかまわない。