高校化学 化学反応とエネルギー
反応熱
[編集]化学反応や状態変化に伴って熱エネルギーの出入りが起こる時の熱のことを反応熱(heat of reaction)という。反応熱には燃焼熱、溶解熱(heat of dissolution)、中和熱(heat of neutralization )、生成熱、融解熱、蒸発熱(heat of evaporation)、昇華熱などがある。熱量の単位にはJ(ジュール)を使う。反応熱の表記は、1molあたりの熱量(単位はkJ/mol)で表すことが多い。
熱化学方程式
[編集]化学反応式の右辺に反応熱を記し、両辺を等号で結んだ式を熱化学方程式(thermochemical equation)または熱化学反応式という。 たとえば、炭素(黒鉛)の1molを燃焼させた場合の熱化学方程式は次のようになる。
- C(黒鉛)+O2(気) = CO2(気)+394kJ
水素を燃焼させた場合、次のようになる。
- H2(気)+ O2 = H2O(液)+286kJ
反応熱は、上の式のように右辺に表す。
- 反応熱は、発熱反応のときは+(プラス)の符号で表し、吸熱反応のときは-(マイナス)で表す。
- 化学反応式での反応の矢印(→ または ←)が、等号(=)に変わる。
- 物質のもつエネルギーはその状態によって異なるので、原則として化学式に物質の状態を気体のときは(気)または(g)を付記、液体のときは(液)または(l)を付記、固体のときは(固)または(s)を付記、水溶液や大量の水は aq のように付記する。また、炭素など特別な物質は黒鉛やダイヤモンドなどの語句を付記するなどして表す。
- 熱化学方程式は、注目する物質1molがもつエネルギーを表す。このため、反応物質や副産物の係数が分数で示される場合もある。
反応熱の種類
[編集]- 燃焼熱
- 1molの物質が完全燃焼するときの反応熱。
- たとえば水素の燃焼熱は、286kJである。
- H2(気)+ O2 = H2O(液)+286kJ
- 溶解熱
- 1molの物質が多量の溶媒に溶解するときの反応熱。
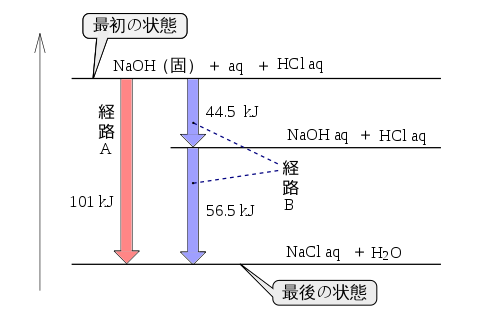
- たとえば水酸化ナトリウムNaOHが水に溶ける場合、水酸化ナトリウムの溶解熱は44.5kJである。
- NaOH(固)+ aq = NaOH aq + 44.5kJ
- 中和熱
- 酸と塩基の中和反応によって、1molの水が生成するときの反応熱。
- たとえば、塩酸と水酸化ナトリウムの中和熱は、56.5kJである。
- HCl aq+ NaOH aq = NaCl aq + H2O(液) + 56.5 kJ
- 水素イオンと水酸化物イオンの中和熱は、56.5kJである。
- H++OH- = H2O(液) + 56.5 kJ
- 生成熱
- 1molの化合物がその成分元素の単体から生成するときの反応熱。
- 融解熱
- 1molの固体が融解して液体になるときに吸収する熱量。
- 蒸発熱
- 1molの液体が蒸発して気体になるときに吸収する熱量。
- たとえば水H2Oの蒸発熱は44.0kJである。
- H2O(液) = H2O (気) - 44.0kJ
- H2O(液)+ 44.0kJ = H2O (気)
- 昇華熱
- 1molの固体が昇華して気体になるときに吸収する熱量。
反応熱の測定
[編集]反応熱を測定するには、外部からの熱の出入りのない断熱した容器が必要である。反応熱などの熱量を測定するための測定器を熱量計という。反応熱の熱量計には、燃焼熱測定用のボンベ熱量計や、溶解熱測定用熱量計などがある。 ボンベ熱量計の測定原理は、試料を燃焼させた後に、容器内の水の温度変化を測定することで燃焼熱を測定する方式である。
熱化学
[編集]図のように、固体の水酸化ナトリウムから塩化ナトリウムを生成する反応には2つの経路があるが、どちらの経路で合成を行っても、出入りする熱量(反応熱)の総和は同じである。
化学反応の反応熱は、反応途中の経過には影響しない。反応の始めの状態と反応の終わりの状態によってのみ、反応熱が決定する。このことをヘスの法則という。
- 結合エネルギー
水素分子1molに432kJのエネルギーを与えると、結合を切り離すことができる。この結合を切り離すのに必要なエネルギーは、結合の強さを表すと考えて、この結合の切り離しに要したエネルギーを結合エネルギー(bond energy)と言う。結合エネルギーは1molあたりのエネルギーで示されるのが通常である。
たとえば水素の結合の切り離しを熱化学方程式で表すと、以下の様になる。

- 例題. 一酸化炭素 CO
検定教科書では、よく練習問題で、COの生成熱を求めさせる問題が出題される。
解法は、図より
- 394ー283=111
よってCOの生成熱は 111 kJ/mol である。
- 答え 111 kJ/mol
- そのほかの例 H2O

- H2(気体)=2H(気体)-432kJ
気体や液体、固体などといった状態変化も同様に、経路によらず、発生する熱量の総和は一定である。
|
|
|
同じ結合でも、周辺の分子の配置や数によって、すこしだけ結合エネルギーが変わってくる。そのため、正確な結合エネルギーの値は、分子ごとに違ってくる。高校では、ふつう、これら周辺分子の影響は扱わないので、無視してよい。
以上の表での結合エネルギーは、おおよそのエネルギーであり、正確なエネルギーの値は分子ごとに違うので、学校のテスト問題などを解くときは問題文を参照のこと。
- 解離エネルギー
3個以上の分子は、結合の数が複数になる。この分子の全ての結合を切り離すのに必要なエネルギーを解離エネルギー(bond dissociation energy)という。通常は1molあたりの切り離しのエネルギー量で解離エネルギーを表す。 解離エネルギーは、その分子の持つ全ての結合の結合エネルギーの総和である。H2やO2などの結合を一個しか持たない分子では、結合エネルギーの値と解離エネルギーの値は一致する。
- 反応熱と結合エネルギー
反応熱や生成熱は、反応の前後の物質の結合エネルギーが分かっている場合は、計算で求められる。その物質の、反応後の結合エネルギーの総和から、反応前の結合エネルギーの総和を引いた値で、反応熱を近似できる。 「近似」といったのは、分子間引力などの、結合の変化以外にもエネルギーが使われる場合があるからである。
- (反応熱) = -(反応前の結合エネルギー) + (反応後の結合エネルギー)
である。
(※ 発展:) 格子エネルギー
[編集](※ 数研出版の教科書、第一学習社の教科書などで紹介されている。)
金属結合や、イオン結合の結晶、共有結晶(ダイヤモンド)などの、結晶を構成するために必要とされるエネルギーのことを「格子エネルギー」という。この格子エネルギーは直接には測定できないので、ヘスの法則で間接的に求める。
※ 範囲外? :エンタルピー
[編集]- ※ 令和3年用の指導要領でエンタルピーが言及されてるので、高校3年あたりの化学(専門化学)あたりで出る可能性がある。

化学の用語で、「エンタルピー」というのがあるのだが、これは何かというと、エンタルピーとは、内部エネルギーUに、圧力Pと体積Vの掛け算 PV を足したもののことである。
物理学では、加えた熱エネルギーをQとすると、熱は物質内部に内部エネルギーUとして蓄えられて内部エネルギーの変化分ΔUに寄与するか、または体積変化による膨張の力学的仕事 PΔV を行うので、
- Q = ΔU +PΔV
のような公式が(物理学では)知られている。
さて、あまり学問的には深い意味が無いのだが、たいていの化学反応の実験では、普通、圧力が一定なので、
- PΔV = PV = Δ(PV)
となる。
熱力学の別の理論で、もともとエンタルピーHという物理量があり、
- H = U+PV
と定義されている。これを差分形を下記のように式変形すると、
- ΔH = Δ(U+PV) = ΔU + Δ(PV) = ΔU + PΔV
と式変形できるので、
もし圧力一定の環境なら、
- Q=ΔH
とも表せる。
だが、あくまでも、圧力一定の環境でしか成り立たないので、あまり、この式に深い意味は無い。
なので、たとえば右に再掲したヘスの図の表などでは、縦軸の「エネルギー」のところを、「エンタルピー」と書いてもいい。