高等学校化学I/溶液の性質
溶液
[編集]
水 H2O に、塩化ナトリウム NaCl を、混ぜると、塩化ナトリウムは水中に拡散していき、やがて肉眼では見えなくなる。そして、混ぜた食塩の量が少なければ、水中にも食塩は沈殿しない。このように、液体に混ぜた物質が、沈殿や凝集物を作らず、液中に拡散することを溶解(dissolution)という。そして、水のように他のものを溶解する物体を溶媒( solvent)という。塩化ナトリウムのように溶けた側の物質を溶質( solute)という。 溶媒が液体の場合に、溶解によって生じた均一な混合液体を溶液(solution)という。
この例の場合は、食塩の量をもっと増やすと、やがて、かき混ぜても、溶けきらずに、時間が経てば底に食塩の沈殿が貯まるようになる。
このように、一定量の溶媒に溶ける溶質の量には限度がある。この溶ける限度の限界まで、溶質が溶けている状態の溶液を飽和溶液(saturated solution)という。これに対して、溶質がまだ溶ける溶液を不飽和溶液という。
電解質
[編集]塩化ナトリウムNaClを水に溶かすと、ナトリウムイオンNa+と塩素イオンCl-のような、正負のイオンに分かれる。このように溶解の際に、イオンに分かれる現象を電離(でんり, ionizasion)という。そして、水に解けて電離する物質を電解質(でんかいしつ, electrolyte)という。 グルコースの溶液は、水に溶けても電解しない。このような水に溶けても電解しない物質を非電解質という。 電解現象と溶解とを混同しないように注意しよう。
電解質のうち、塩化ナトリウムの水溶液と、酢酸の水溶液との比較をすると、酢酸は溶解をするし電離もするが、塩化ナトリウムよりも電離しづらいことが分かっている。 電解質のうち、塩化ナトリウムのように電離をしやすい物質を強電解質という。酢酸のように、溶液中のイオンの電離が弱いが、電離をしている物質を弱電解質という。
水和
[編集]

水分子の酸素原子が分子中の電子を引き付けるため、酸素原子は負の電荷を帯び、水素原子は正の電荷を帯びる。このような分子を極性分子(polar molecule)という。
塩化ナトリウムを水に入れると、電離したそれぞれのイオン原子1個ずつについて、ナトリウムイオンNa+は水分子の陰性の酸素原子と引き合い、塩素イオンCl-は水分子の陽性の水素原子と引き合う。その結果、イオン原子は、周囲を水の分子によって囲まれる。 このように、溶質原子が水分子によって取り囲まれる現象を水和(すいわ, hydration)という。溶媒が水でない場合には、イオンが溶媒に取り囲まれるこのような現象は、溶媒和(solvation)と呼ばれる。
食塩の水和では、ナトリウムイオンでは隣に水分子の酸素原子の側が来る。塩素イオンでは、隣に水分子の水素原子の側が来る。
水和しているイオンを水和イオン(hydrated ion)という。
親水基と疎水基
[編集]エタノールC2H5OHやグルコースC6 H12 O6 などは水に良く溶ける。このエタノールの分子は、分子中にヒドロキシ基 OH を持つ。エタノールでは、このヒドロキシ基の部分が、水分子と水素結合を生じて、エタノール分子が水和をする。グルコース分子も、実はヒドロキシル基を持っており、このヒドロキシ基の部分が、水分子と水素結合を生じて、グルコース分子が水和をする。
このエタノール分子中のヒドロキシ基のように、水和されやすい原子団の部分を親水基(しんすいき, hydrophilic group)という。水和されやすい性質を親水性(hydrophilicity)という。
これに対して、ベンゼンC6H6などは水に溶けない。このような分子は極性をもたない無極性分子である。一般に、親水基を持たない無極性分子は、水には溶けない。
また、エタノール分子中のエチル基C2H5の部分は、極性を持たず、この部分は水和には寄与していない。この分子の他にも、一般の炭化水素CmHnは無極性で、水和には寄与しない。このような、炭化水素のみからなりエタノールと違って親水基を持たない炭化水素分子は水和されにくい。このような親水性をもたない原子団を疎水基(そすいき, hydrophobic group)という。水和されにくい性質を疎水性(hydrophobicity)という。
無極性分子からなるヨウ素I2やナフタレンC10 H8 は、無極性分子の液体であるベンゼンC6 H6や、四塩化炭素CCl(テトラクロロメタン)には、よく溶ける。
このように無極性分子の物質は、無極性分子の液体に溶けやすい。いっぽう、極性分子の物質は、極性分子からなる水に溶けやすいのであった。
これらのように、一般に極性の似ている分子は溶けあいやすい。

溶解度
[編集]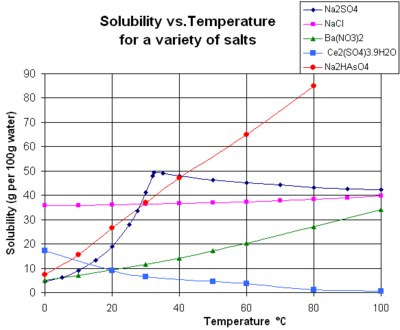
ある一定の温度で、ある一定の質量の溶媒に対して、溶質を溶かして、溶質が溶けきる最大限の飽和溶液を得た場合、その飽和溶液に溶けている溶質の量を溶解度(solubility)という。つまり、溶解度とは、未混合の溶媒に対して、「この溶媒は、これから、どれだけの溶質を溶かせるか」という能力のことである。溶解度と濃度とは、別の概念なので、混同しないように。
溶解度の数値の表し方は、2種類ある。 一般的なのは、溶媒の質量100gに対して、溶かせる溶質の質量の割合[g/100g]、またはその溶質の質量[g]で定義する方法である。
溶解度の単位は、無次元で表す場合もあるが、無次元だと状況が分かりづらいという考えのもと、[g/100g]や、[g]などと表す場合もある。
溶解度は、溶媒の温度によって変化する。溶媒が水の水溶液の場合、水の温度によって、溶解度は変化する。 水に溶かす溶質では、一般に水の温度が高まるほど、ほとんどの溶質で、溶解度は高まる。ただし、例外的に水酸化カルシウムCa(OH)など、いくつかの分子では、温度上昇によって溶解度が下がる物質もある。
溶解度の温度変化をグラフで表したものを溶解度曲線(solubility curve)という。
再結晶法
[編集]不純物の混ざった混合物の固体に対して、その各成分の溶解度が大きく異なる場合は、その混合質を、熱した溶媒に飽和するまで溶かし、飽和後に冷却をしていけば、溶解度の小さい物質の側から先に、結晶が析出をしていくので不純物を取り除ける。このように、何らかの方法で溶質の結晶を析出させて不純物を取り除き精製する方法を再結晶法(recrystallization)という。
「再結晶」という語について、この例では、水溶液を用いた再結晶を紹介したが、「再結晶」とは、なにも水溶液にかぎらず、何らかの方法で結晶をいったん溶解または溶融させて、そのあとに結晶を析出させてえられた結晶ならば、一般に再結晶という。
なお、溶媒を冷却していく時に、あらかじめ他の実験で得られた、その物質の、平均的な溶解度を超えるまで冷やしても、析出しない場合がある。このように通常の溶解度を超えて溶質を含んでいる状態を過飽和(かほうわ, supersaturation)という。溶質を溶解度よりも過飽和に含んでいる溶液のことを過飽和溶液という。過飽和の状態は不安定であるので、過飽和溶液の場合は、少量の撹拌や振動などが加わるだけで、結晶の析出を始める。
溶質の種類によっては、再結晶法で結晶分子中に水分子が化合した結晶が得られる場合がある。このように結晶分子と化合している水を結晶水あるいは水和水という。結晶水は、加熱などによって除去できる場合が多い。 結晶から水和水を除去することを無水化などという。無水化して得られた結晶水を含まない固体を無水物(むすいぶつ, anhydride)という。 結晶が水和水を含む物質に対する溶解度の定義は、無水物の質量を、溶質の質量とみなして、溶解度を定義する。
沸点上昇
[編集]砂糖水や食塩水は、100℃にしても沸騰しない。 不揮発性の溶質を溶媒に溶解させると溶液の沸点が上昇する現象を沸点上昇(boiling-point elevation)という。 純溶媒の沸点t1 [K]と溶液の沸点t2[K]との沸点の差Δtb=t2- t1 [K] を沸点上昇度(boiling-point elevation constant)という。
水が蒸気になる時に、水に溶けていた溶質は蒸気からは追い出され、蒸気には溶質は混じらない。このときに、溶質を追い出すためには、蒸気にエネルギーを与えなければならない。その結果、溶質がなかった場合より、高い温度にしないと沸騰しないのである。
沸点上昇Δtb は質量モル濃度c[mol/kg]に比例するので、式で書けば、
- Δtb = Kb c
である。
なお、「質量モル濃度」とは、その溶媒 1kgあたりに溶けている、溶質のモル数のことである。
なお、沸点上昇度Δtbの比例係数をKb とした。比例係数Kb の単位は、[K/(mol/kg)]つまり[K・kg/mol]で定義される。この比例係数Kb [K・kg/mol]をモル沸点上昇(molal boiling-point elevation constant)という。
蒸気圧降下
[編集]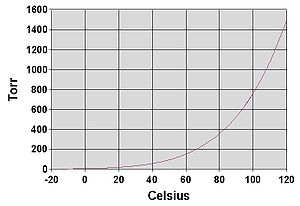
水は通常は100度において沸騰し、その時の蒸気圧は101.325kPaという標準的な大気圧に等しい。
真空ポンプなどで水が入った溶液の周囲の気体を減圧していくと、100℃にならなくても沸騰する。このときの気体圧を飽和蒸気圧(saturated vapor pressure)という。この飽和蒸気圧が、溶液では下がり、より減圧しないと沸騰しなくなる。このことを蒸気圧降下(vapor pressure depression)という。
凝固点降下
[編集]砂糖水や食塩水を冷やしても0℃では凍らない。このように不揮発性の溶質を溶媒に溶かすと溶媒の凝固点が下がる。 水が氷になる時に、溶質を追い出す。このときに、溶質を追い出すためには、溶質の動きを押さえなければならない。その結果、溶質がなかった場合よりも低い温度にしないと氷にならないのである。
不揮発性の溶質を溶媒に溶解させると溶液の凝固点が下がる現象を凝固点降下(freezing-point depression)という。 純溶媒の凝固点t1 [K]と溶液の凝固点t2[K]との凝固点の差Δtf=t1- t2 [K] を凝固点降下度(freezing-point depression constant)という。
凝固点降下度は質量モル濃度 m [mol/kg] に比例するので、凝固点降下度 Δtf の比例係数を Kf としたとき、つまり
- Δtf = Kf m
の比例係数 Kf の単位は、 [K/(mol/kg)] つまり [K・kg/mol] で定義される。この比例係数 Kf [K・kg/mol] をモル凝固点降下(molal freezing point depression constant)という。
過冷却
[編集]
右図のように、冷却による温度変化と時間との関係をあらわしたグラフのことを冷却曲線という。
液体を冷却していって凝固点になっても、すぐには凝固しない。この状態を過冷却(かれいきゃく、supercooling)という。
冷却が進んで凝固点よりも少し温度が下がってから、凝固点まで温度が上がり、凝固が始まる。
凝固点降下と過冷却の関係は、右図のグラフのようになる。
浸透圧
[編集]半透膜
[編集]セロハンは、水分子など小さな分子は通すが、スクロース分子などの大きな分子を通さない。このように、分子サイズの小さな分子を通し、分子サイズの大きな分子を通さない膜を半透膜(semipermeable membrane)という。
半透膜には、セロハン膜の他にも、動物の膀胱膜(ぼうこうまく)や、セルロースを硝酸でニトロ化した化合物の一種のコロジオン(collodion)という物質から作られるコロジオン膜や、生物の細胞膜がある。
ろ紙はセルロースなどの溶質を通してしまうため、ろ紙は半透膜ではない。
浸透圧
[編集]
U字管の下部を半透膜で仕切って、片側に純水を入れ、もう片方にスクロース溶液を入れると、純水の一部がスクロース溶液の側に移動して、純水の液面が下がる。この現象を浸透という。このように両溶液に濃度差がある場合は、溶液を薄めて濃度差を無くそうとする力が働くので、この濃度差を無くそうとする力を浸透圧(osmotic pressure)という。
両液の水位を等しくするには、スクロース水溶液に圧力を加えないといけない。この圧力の大きさを浸透圧の大きさとする。
浸透圧を数値化する際や数式化する際に、純水を基準にして、純水と溶液との浸透圧を、単に浸透圧と言って用いる場合が多い。
ファントホッフの式
[編集]絶対温度Tで、濃度c[mol/L]の溶液の浸透圧Π[Pa]は、気体定数をRとして、 Π = cRT であることが知られている。
モル濃度c[mol/L]は、溶液中のモル数をn[mol]として、その体積をV[m3]とすれば、
- c=n/V
である。(1L=1000cm3なので、モル濃度を体積に換算できる。) これを浸透圧の公式に代入して、
- ΠV = nRT
という式が得られる。このように、気体の状態方程式 PV = nRT と似た形の式が得られる。この ΠV = nRT の式を浸透圧に関するファントホッフの式という。
コロイド溶液
[編集]
直径がおよそ10-9mから、10-7mの粒子をコロイド粒子(colloid)という。デンプンはコロイド粒子である。
コロイド粒子はろ紙を通過できるが、半透膜を通過できない。
コロイド粒子が液体中に均一に分散している液をコロイド溶液という。
コロイド粒子を分散させている液体を分散媒( disperse medium)といい、コロイド溶液中のコロイド粒子を分散質( dispersoid)という。
水酸化鉄(Ⅲ)のコロイド溶液
[編集]沸騰している水に、塩化鉄FeCl3 を少量ほど加えると、赤色の水酸化鉄Fe(OH)3 のコロイド溶液ができる。
Fe(OH)3 は水に不溶であり、これのコロイド溶液は不溶のFe(OH)3 が水に分散したものである。このような不溶の物質が分散したコロイド溶液を分散コロイド(dispersion colloid)という。
電気泳動
[編集]U字管にコロイド溶液を入れ、電極を用いて、直流電圧を掛けておくと、コロイド粒子はいっぽうの電極の側に移動する。 電気を用いて液体の中から特定の粒子を移動させる現象を電気泳動(electrophoresis)という。
このことから、コロイド粒子は電荷を帯びている事が分かる。コロイド粒子は溶液ごとに、正または負の電荷を帯びている事が分かる。
水酸化鉄 Fe(OH)3 は正に帯電している。コロイド粒子が正に帯電している場合を正コロイド (positive colloid)という。また水酸化アルミニウムAl(OH)33は正に帯電している。水酸化アルミニウムも正コロイドである。
一般に金属の水酸化物と液体との混合物がコロイド溶液になる場合は、正コロイドであることが多い。
負電荷び帯電するコロイドを負コロイド(negative colloid)という。負コロイドの具体例は、粘土、イオウS、CuS などの金属硫化物、デンプン,Au, Ag, Pt, などである。
コロイドが沈殿しないのは、この帯電によって、互いの粒子どうしを反発させているからである。
では、なぜコロイドが電荷を帯びるのか。水酸化鉄Fe(OH)33のコロイドが正に帯電するのは、化合物中のOH基の部分が、溶液中の陽イオンのH+あるいはFe+を吸引しやすいからだと考えられている。
セッケンのコロイドでは、コロイド粒子そのものがイオン化している。 セッケンは
と電離する。
疎水コロイドと親水コロイド
[編集]疎水コロイド
[編集]水酸化鉄Fe(OH)3 のコロイド溶液に、少量の電解質を加えるとコロイドが沈殿する。 粘土のコロイド溶液に電解質を加えても同様に沈殿をする。 水酸化鉄は正コロイドであり、粘土は負コロイドであることから、この沈殿現象はコロイドが正負どちらの電荷でも生じる。
少量の電解質で沈殿するのは、最初に加えた電解質によって、コロイド粒子に反対符号のイオンが吸着し、その結果、分子間力が増えた結果、凝集しあって沈殿するからである。
このように少量の電解質で沈殿するコロイドを疎水コロイド(hydrophobic colloid)という。疎水コロイドが少量の電解質で沈殿する現象を凝析(ぎょうせき, flocculation)という。
なお、イオンの価数のおよそ6乗に比例して、凝析の効果が強まる。
電解質が反対符号の電荷を価数をもつほうが、より少量の電解質の添加でコロイドを沈殿させやすい。
たとえば正コロイドのFe(OH)3 を沈殿させるために加える電解質では、1価のClよりも2価のSO42-のほうが26倍=64倍ほど有効である。
疎水コロイドの凝析で、イオンの価数の6乗に比例して、凝析の効果が強まるという、この法則をシュルツ・ハーディの法則という。
- (※ 余談:) 粘土のコロイドが塩分で凝集するが、これは地理で習う三角州の形成の一因だろうと考えられている(※ 第一学習社の見解)。海水の陽イオンによって粘土のコロイドが凝集するという見解である。
親水コロイド
[編集]いっぽう、デンプンやタンパク質のコロイドは、多量の電解質を加えないと沈殿しない。このデンプンやタンパク質の化学式を見ると、-OH基や-COOH基や-NH2基などの基がある。これらは水と吸着しやすい親水性の原子団の親水基である。 このため、沈殿させるには、水との吸着を無くすために多量の電解質を加えて、溶液全体のイオンにおける、水の影響を薄めて吸着を無くさなければならない。電解質を加えても溶液全体の電荷の合計自体は同じだが、水素結合は、他の結合よりも強いことを思いだそう。
デンプンやタンパク質などのように、水和しているコロイドを親水コロイドという。 親水コロイドに多量の電解質を加えて沈殿させることを塩析(えんせき, salting out)という。
電気泳動に関して、親水コロイドは水和のため、疎水コロイドと比べて、親水コロイドは移動速度が小さい。
保護コロイド
[編集]疎水コロイドと親水コロイドとを混ぜたコロイド溶液は、どういった特性を持つだろうか。 疎水コロイドが、電解質を加えても沈殿しにくくなる。
親水コロイドは疎水コロイドと吸着しても、親水コロイドの親水性のため、少量の電解質を加えても親水コロイドは沈殿しない。その親水コロイドと吸着した疎水コロイドは、吸着している親水コロイドが少量の電解質では沈殿しないため、一緒の疎水コロイドも少量の電解質では沈殿しない。
このように親水性の高い親水コロイドとの吸着を仲立ちとして疎水コロイドが沈殿しづらくなる現象を、親水コロイドによる保護あるいは保護作用といい、この親水コロイドによる疎水コロイドの保護を目的として加える親水コロイドを加えた場合、その親水コロイドを保護コロイドという。
保護コロイドの例として、タンパク質の一種であるゼラチンや、墨汁に含まれるニカワなどがある。
ゼラチンもニカワも親水コロイドでもある。
インキに含まれるアラビアゴムも保護コロイドである。ゴムというと、つい連想で輪ゴムのような固体状のものを連想しがちかもしれないが、このアラビアゴムの純物質は、多糖類であり、水溶性が高い親水コロイドである。
コロイドの生じる要因
[編集]会合コロイド
[編集]
セッケン分子は、親水性の水に水和しやすい部分と、疎水性の水とは水和しない部分とからなる。 疎水性の部分が、まるで疎水コロイドと同じように集まり、その結果としてセッケン分子は数百個ほど集まる。しかし、分子に親水性の部分があるので、まるで保護コロイドのように、セッケン分子は沈殿せず、コロイド溶液であり続ける。
このセッケン分子が凝集する際、親水性の部分を外側に向けて集まり、疎水性の部分は内側に向けて集まる。 セッケン分子の集合体のように、親水基と疎水基を持つ分子が、親水基を外側に向けて集合したものをミセルという。
このようなコロイドを会合コロイド(かいごうコロイド, association colloid)という。会合コロイドは親水コロイドの一種に分類される。
分子コロイド
[編集]デンプンやタンパク質の水溶液は、水溶液中での分子1個の大きさはコロイド粒子の大きさである。このような分子1個の大きさがコロイドの大きさであるため、コロイド溶液となった物質およびその分散質を分子コロイド(molecular colloid)という。
分散コロイド
[編集]溶媒には本来溶解しない不溶性物質が細かく分散される事によって構成されるコロイド。 炭素や水酸化鉄など疎水コロイドの多くを占める。
ゾルとゲル
[編集]ゲル
[編集]
ゼラチンのコロイド溶液を冷やすと固体状に固まる。寒天のコロイド溶液を冷やすと固体状に固まる。 このようにコロイド溶液が冷えて固まったものをゲル(ドイツ語:Gel)という。
ゲルを乾燥させたものをキセロゲル(xerogel)という。高野豆腐やシリカゲルは、キセロゲルである。 乾かした寒天やゼラチンなどもキセロゲルである。キセロゲルを水につけると水を吸って膨らむ。これを膨潤(ぼうじゅん)という。
ゾル
[編集]コロイド溶液とも言う。 コロイド粒子が分散している流動性のある溶液のこと。
チンダル現象
[編集]コロイド粒子が光を散乱させ、光の通路が輝いて見える現象。
ブラウン運動
[編集]コロイド粒子が、熱運動する分散媒粒子に衝突されて行う不規則な運動。
その他(※ 範囲外)
[編集]水50mLとエタノール50mLを混ぜると、合計の容積は97mLになり、単独の液体の体積の単純な和よりも小さくなる。
これは、エタノール分子の方が水分子より大きいため、エタノール分子の間に水分子が入り込んでいるためである。


