中学校理科 第1分野/物質のすがた
物質のすがた
[編集]ここでは物質の性質について調べる。まず上であげた物質の性質について簡単に解説する。最初にここで扱う物質の分類について説明する。 物質の中にはいくつかの物質が混ざってできているものがある。 例えば、空気はw:酸素(さんそ)やw:窒素(ちっそ)などいくつかの気体が混ざってできている。このようにいくつかの物質が混ざってできている物質のことをw:混合物(こんごうぶつ、mixture)と呼ぶ。いっぽう、混合物でなく、混じりけのない物質のことをw:純物質(じゅんぶっしつ、pure substance)と呼ぶ。
純物質については、化学変化を扱う項で説明する。
有機物と無機物
[編集]木材や砂糖などは燃えると二酸化炭素を発生する。木材は炭素を含み、砂糖も炭素を含む。このように炭素を含み、天然に存在する物質を有機物(ゆうきぶつ、organic compound)という。
- 有機物の例
- 砂糖、紙、木、プラスチックなど
有機物は、加熱すると、こげる。加熱した有機物の周囲の気体は、二酸化炭素をふくむので、石灰水の入った集気びんなどで集めて、びんをふって石灰水にまぜれば、白くにごる。また、水が発生する。
いっぽう、ガラスや食塩などのように炭素を含まない物質や、燃えても二酸化炭素をふくむ物質を出さない物質を無機物(むきぶつ inorganic compound)という。
- 無機物の例
- 鉄(スチールウール)、水、ガラス、食塩、アルミウム、(二酸化炭素)など
二酸化炭素自身は、無機物に分類するのが普通である。 無機物は、燃えない物が多い。なので、加熱しても、こげない物が多い。たとえば食塩やガラスは燃えない。ただし、無機物でも、スチールウールなどのように燃える物もある。
加熱した無機物の周囲の気体を、石灰水の入った集気びんなどで集めて、びんをふって石灰水にまぜても、なにも白くにごらない。
有機物は、生き物の体内でなくても、科学実験で、人の手によって人工的に合成できる。1828年にウェーラーによって、尿素(にょうそ)が世界で初めて人工的に合成された。それ以前は、有機物は、生き物の体内でないと、つくれないと思われていた。
プラスチック
[編集]
プラスチック材料は,天然には産出せず、主に石油などを原料として人工的につくられた物質で合成樹脂(ごうせいじゅし、synthetic resin)ともよばれる。
プラスチックは軽くて、割れにくく、加工しやすいので、いろいろな形のものをつくることができ、我々の生活を快適にしている物質といえる。
プラスチックは,炭素をふくむ物質であり、有機物のなかまである。そのため共通して加熱するととけてやわらかくなったり、燃え出したりする性質がある。
実験などでプラスチックを燃やすときは、換気をしながら実験すること。プラスチックプラスチック素は燃やすと、一般に二酸化炭素をふくむ気体が発生する 。 プラスチックの種類によっては、ダイオキシン有害な成分をふくむ気体もあるので換気をする必要があり、自治体によってはダイオキシン類対策特別措置法関連条例で禁止されている場合もある。
実験などは、学校の理科教員の指示にしたがって行うこと。
中学校で有機物として習うようなプラスチックは、つまり、ポリエチレン・ポリスチレン・ポリエチレンテレフタラート・ポリプロピレン・ポリ塩化ビニルは、燃やすと二酸化炭素が出てくる。これらのプラスチックを燃やして出た気体を集気ビンなどで集め、石灰水に通すと、二酸化炭素をふくむため、石灰水は白くにごる。
また、プラスチックは一般に熱や電気を通しにくい性質をもっている(しかし、近年は電気を通すプラスチックも開発されている)。

プラスチックにはいろいろな種類がある。例えば、ペットボトルに使われている栓はポリエチレン(PE)でできており、本体はポリエチレンテレフタラート(PET)とよばれるプラスチックである。
| 種類 | 用途 | 性質 | 密度/(g/cm3) |
|---|---|---|---|
| ポリエチレン (PE) |
|
水に浮く。 油や薬品に強い。 |
0.92~0.97 |
| ポリエチレンテレフタラート (PET) |
|
透明性が高い。 圧力に強い。 水より重く、沈む。 |
1.38~1.40 |
| ポリスチレン (PS) |
|
軽い。 | 1.05~1.07 |
| ポリプロピレン (PP) |
|
熱に強い。 水より軽く、水に浮く。 |
0.90~0.91 |
| ポリ塩化ビニル (PVC) |
|
燃えにくい。 薬品に強い。 水より重く、沈む。 |
1.2~1.6 |
金属
[編集]この節では、固体の金属の性質を考える。
- 金属は、電気を通しやすい。
- 金属は熱を伝えやすい。
- 表面にかがやきがある。金属光沢(きんぞく こうたく)がある。
- 金属は、力を加えると、のばせたり、広げられたりする。なお、のばせる性質を延性(えんせい)という。たたくと広がる性質を展性(てんせい)という。
金属は、すべて無機物である。
フライパンで加熱する部分に鉄が用いられたり、やかんで加熱部に鉄などが用いられるのは、金属が熱を伝えやすいからである。フライパンの手で持つところは、熱を伝えにくいようにプラスチックなどで出来ている。
金属では、電気と熱を伝えやすい。このことから、「金属中で熱を伝えている物質は電気ではないのか?」という疑問が浮かんでくるかもしれない。じっさいに、金属中では電気が熱を伝えていることが、さまざまな実験により確かめられている。
- 磁石につくかどうかは、金属の性質ではない。銅は磁石につかないしアルミニウムも磁石につかないが、鉄は磁石につく。鉄も銅もアルミニウムも金属である。
- ※範囲外 なお、スチール缶やスチールウールなどの「スチール」(steel)とは、鋼(はがね)のことである。鋼(はがね)とは、鉄と炭素の合金のこと。スチールの成分は、鉄がほとんどで、ほんの少し、炭素が混ざっている。製鉄(せいてつ)のさい、鉄に炭素がまざって造られると、硬い(かたい)鋼になる。
- ※範囲外 「ステンレス鋼」(ステンレスこう、stainless steel)とは、鉄を主成分に、クロムなどが10%ほどの多い割合で加わった合金。このため、ステンレス鋼は磁石につかないのが、普通である。
物質の密度
[編集]物質の密度(みつど、density、デンシティ)とは、物質の単位体積あたりの質量を表す値である。密度の単位は、 g/cm3 などである。
質量・体積と密度の関係 密度 [g/cm3] = 物質の質量 [g]
物質の体積 [cm3]
- 密度 = 質量 ÷ 体積
密度は形状などによらず、同じ物質なら、密度は一定である。このため、ある物質の質量と体積は比例する。
さて、同じ体積の紙と銅とで重さを比べた場合、銅の方が重い。このことは、銅の密度が紙の密度よりも大きいことを示している。
ある物質の密度が、水の密度 1.00 g/cm3 よりも軽いとき、物質は水に浮く。なお、 リットルとcm3の関係は、
- 1 L = 1000 cm3 である。
- 実験
同じ体積の紙と銅を用意し、その重さの違いを確かめよ。重さの違いを確かめるにはw:天秤(てんびん、balance)などを利用することができる。
- 密度について
密度はあらゆる物質が持つ量であり、その値は物質によって非常に異なっている。水のような液体や、空気のような気体の密度は通常固体の密度よりも小さい。すぐ後で扱うが、多くの物質は温度(と圧力)によって、その状態を"気体"、"液体"、"固体"に変化させる。このとき、物質の状態変化に伴って、物質の密度はこの順に大きくなることが普通である。つまり、ほとんどの物質で、固体の密度がもっとも大きく、つぎに液体の密度が大きく気体の密度はもっとも低い。
水はこの一般則の例外であす。水においては、"固体"(氷)の密度が"液体"(水)の密度よりも小さい。これは"氷が水に浮かぶ"性質につながっている。水の密度は、4 ℃ の液体のときが、もっとも密度が高い。
密度の単位は g/cm3 (グラム毎立方(まいりっぽう)センチメートル ) またはkg/m3 (キログラム毎立方メートル ) で与えられる。
- いろいろな物質の密度
- (温度をしめしていない物は、20℃での密度の値)
|
|
|
天びんの使い方
[編集]- 上皿てんびん


図では、薬包紙が見えませんが、理科の実験では、粉を乗せる時は薬包紙を使ってください。
- (※ 日本の中学校で使うような上皿てんびんの画像を募集中。だれか撮影するか描くかして作ってください。)
質量を測定するときは、上皿天びん(うわざらてんびん)などの天びん(てんびん)を用いる。
- 上皿天びんの操作方法
物質の質量を測定する場合は、片側に被測定物をのせ、反対側に分銅を載せる。分銅を質量の基準とする。 両方の皿の釣り合いを見て、質量を判断する仕組みである。 なので、皿に物を乗せる前に、両方の皿が釣り合っているかどうかを確認する必要が有る。もし、釣り合っていなかったら天びん本体に調整用のねじ等が付いているので、それで両方の皿が吊り合うように調整してから、皿に物を乗せる。 粉末などを測定する場合は、粉末が溢れたりしないように薬包紙(やくほうし)などを用いる。この場合は薬包紙を分銅を載せる側の皿にも置いた上で上記の調整を施したり、もしくは薬包紙の質量をあらかじめ測定しておく。
分銅は、あまり直接には、手で触らないようにする。 手の皮脂などが分銅につくと、その皮脂などの質量が追加した分だけ、重さが変わってしまうからである。 軽い分銅を皿に載せたりおろしたりする場合なら、専用のピンセットが天びんに付属していることがあるので、その付属のピンセットなどを用いる。
上皿てんびんの手順
- 上皿てんびんを水平な台の上に置く。
- 両方のうでに、それぞれ皿をのせる。まだ、分銅も測りたい物も、のせない。
- 指針が目もりの中央をさすように、調節ねじ で調整する。
- 右利きの場合、左の皿に、測りたい物をのせる。右の皿には、すこし質量が重そうな重りをのせ、つりあうように分銅を変えていく。(粉末の試料をのせる場合は、薬包紙を使う。)
- 針のふれを見て、左右がつりあえば、そのときに左右のうでにかかる重さが、つりあっている。
- 使いおわったら、皿を片方のうでに、重ねておく。
- 電子てんびん

電子てんびんの場合、上皿てんびん とは違い、左右のうでは無い。
電子てんびんの手順
- 電子てんびんを水平な台の上に置く。
- 何ものせない時に、表示が 0g(ゼログラム) になるようにセットする。重さの表示値が「0.0」や「0.00」などの表示になるようにする。
- 薬包紙を使う場合は、さきに表示を 0g にセットしてから、薬包紙をのせ、もう一度、表示を 0g にセットする。
- はかりたい物をのせる。薬品の重さをはかりたい場合は、静かに、少しずつ、のせる。
- 表示値を読み取る。表示値が、はかりたい物の重さである。
気体の性質
[編集]気体の集め方
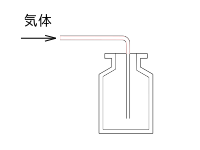
[編集]- 水上置換法

科学実験で発生させた気体を集める場合、気体が空気よりも軽い物質の場合は、空気中を上昇していくので、補集用のフラスコなどは下向きにして集める必要がある。 水に溶けない気体の場合は、水を満たした水槽に、フラスコを開いた口を下向きにして入れ、フラスコの内部は水(みず)で満たしておき、このフラスコの中にガラス管などで気体を導く。この方法を水上置換法(すいじょうちかんほう、)という。
酸素や水素は水に溶けにくいので、水上置換法で集められる。
水に溶ける物質でも、溶けにくい物質ならば、水上置換法で集める場合もある。
- 上方置換法
空気よりも軽い気体を集める場合で、水に溶けやすい物体を集める場合や、水に溶けにくい気体でも水に溶かしたくない場合などは、水を使わない方法で集める必要がある。フラスコの開いた口を下向きにし、そのフラスコの内部にガラス管などで気体を導く。このとき気体を導くための管は、フラスコの奥の上の方まで入れる必要がある。このような集め方を上方置換法(じょうほうちかんほう)という。
- 下方置換法
空気よりも重い気体を集める場合は、補集用のフラスコなどは、開いた口を上向きにして集める必要がある。 この集め方を下方置換法(かほうちかんほう)という。
-
上方置換法の図。気体を送るためのガラス管は、集気ビンの奥のほうまで入れる。
-
下方置換法の図。気体を送るためのガラス管は、集気ビンの奥のほうまで入れる。
いろいろな気体の性質
[編集]ここでは、理科の実験でよく用いられる気体の性質についてまとめる。
二酸化炭素
[編集]
- 作り方の一例
- 石灰石に、うすい塩酸をくわえると、作れる。石灰水のかわりに、貝殻や卵の殻、大理石やチョークを用いても良い。石灰石は、炭酸カルシウムという物質で出来ている。この炭酸カルシウムと塩酸が反応することで二酸化炭素が出来る。
- 石灰石 + うすい塩酸 → 二酸化炭素
- その他の作り方
- 炭酸水素ナトリウム( 重曹(じゅうそう) )を加熱する。炭酸水素ナトリウムの加熱分解(かねつ ぶんかい)で、二酸化炭素が出来る。
- ふくらし粉(ふくらしこ)(=ベーキングパウダー)を加熱する。主成分が重曹(じゅうそう)なので。
性質
- 二酸化炭素は燃えない。助燃性(じょねんせい)も無い。そのため、二酸化炭素の集まったビンに線香を入れると、すぐに線香の火は消える。
- 二酸化炭素は空気より重い。二酸化炭素の密度は、空気の密度の約1.5倍。そのため、化学反応で発生させた二酸化炭素を集めるときは、下方置換法で集められる。
- 二酸化炭素の水に溶ける量が小さいので、水上置換法で集めても良い。
- 二酸化炭素は水に少し溶け、水溶液は 弱い酸性 である。二酸化炭素の溶けた水溶液のことを 炭酸水(たんさんすい) という。
- そのため、炭酸水は青色リトマス試験紙を赤色に変える。
- また、炭酸水に緑色のBTB溶液を加えると、BTB溶液を黄色く変わる。
- 二酸化炭素を石灰水に通すと、石灰水が白くにごる。化学実験で発生した気体が二酸化炭素かどうかの確認方法に、この石灰水との反応が用いられることが多い。
- 石灰水の白い色は、炭酸カルシウムが発生したためである。もとの石灰水は水酸化カルシウムをふくんでおり、石灰水に二酸化炭素を通すと、この水酸化カルシウムが炭酸カルシウムに変化する。炭酸カルシウムは水には溶けず色が白いので、石灰水が白くにごる。
- 関連事項など
二酸化炭素(にさんかたんそ、carbon dioxide)は、空気中に0.03%程含まれる気体であり、酸素原子に炭素原子が2つ結合した分子からなる気体である。二酸化炭素は我々に取って身近な気体である。我々は呼吸をする際、酸素を吸収して二酸化炭素を排出している。これは我々が食物からエネルギーを取り出すさいに酸素を消費すると同時に、二酸化炭素を排出することと対応している。一方、植物はw:光合成(こうごうせい、photosynthesis)によって二酸化炭素を吸収しつつ、酸素を排出する。これは呼吸と逆の反応である。光合成について詳しくは、中学校理科 第2分野を参照。
二酸化炭素は炭素と酸素が結合する(炭素が燃える)ことで生じる。我々の身の回りにある物の多くも炭素を含んでいる。例えばw:綿(めん、cotton、コットン)などのw:天然繊維(てんねんせんい、natural fiber)でできた衣類は炭素を含んでおり、それらが燃えるときには二酸化炭素が発生する。また、w:石油(petroleum、ペトロレウム)やガソリン(gasoline)も炭素を含んでおり、燃えるときには二酸化炭素を発する。
二酸化炭素は空気よりも重い気体であるので、二酸化炭素を集める時には捕集器具を下方に置く(下方置換法 w:下方置換)。二酸化炭素を水に溶かした溶液は、w:炭酸(たんさん、carbonic acid)と呼ばれ、弱い酸性の水溶液になる。
酸素
[編集]
w:酸素(さんそ、oxygen、英:オキシジェン)は空気中に20%ほどの割合で含まれる気体であり、我々にとって身近な気体である。我々はw:呼吸(こきゅう、breathing、ブリジング)をする際体内に酸素を取り入れている。これは、我々が生命活動を行うのに必要なエネルギーを生産するために、食物から吸収した栄養素と酸素とが必要になるからである。
また、酸素は物体が燃えるために必要である。例えば、木に火をつける際、よく火が起こりかかった所に息を吹きかけて火を起こすが、これは木が燃えるために必要な酸素を送り込んでいるのである。より詳しくいえば、木の表面は炭素を含んだ物質でできており、物質中の炭素と空気中の酸素が結合する反応によって熱が発生するのである。
物が燃えるのに、酸素との結合が必要なことを、酸素の 助燃性(じょねんせい) と言う。可燃物が濃度の高い酸素と反応すると、火花を出して、はげしく燃えるので、実験時は取扱いに注意のこと。

実験室では、薄い過酸化水素水(かさんかすいそすい)を用いて酸素を発生させることが多い。w:過酸化水素水(hydrogen peroxide)は平時でも酸素と水とに分解するが、二酸化マンガン(にさんかマンガン、manganese dioxide)を加えることでその反応を促進することができる。ただし、このとき反応を行うのはあくまで過酸化水素水のみであり、w:二酸化マンガンは反応の際に変化しない。このように反応の際に自身は変化せずに他の反応を促進する働きがある物質を、触媒(しょくばい、catalyst、カタリスト)と呼ぶ。(w:触媒について詳しくは高等学校化学などを参照。)
- 二酸化マンガン + オキシドール → 酸素
- オキシドール
なお、消毒薬で「オキシドール」というものがあるが、これは過酸化水素水の水溶液である。
過酸化水素水は血液に混ざると、血液中に含まれるカタラーゼという物質が触媒の作用をし、過酸化水素水を分解して、酸素と水に分解する。
消毒薬のオキシドールを傷口につけると発泡するのは、酸素が発生したためである。
生のレバーにもカタラーゼがふくまれているので、生レバーにオキシドールをかけても、酸素が発生する。
その他の作り方
- 酸化銀を加熱して、発生した気体を水上置換法で集めれば酸素である。
- 酸素系漂白剤に湯を加える。
※ 製品表示に「まぜるな危険」と書いてある漂白剤や洗剤などは、まぜてはいけない。有毒な気体が発生する恐れがある。
酸素の集め方
- 水に溶けにくく、空気より軽いので、水上置換法で集める。
魚などの水中の生き物は、水に、わずかに溶けている酸素を呼吸している。
水素
[編集]
水素(すいそ、英: hydrogen、ハイドロジェン)は非常に軽い気体であり、空気中で燃える。(可燃性(かねんせい)である。) 水素が燃えるとき、水素が酸素と結合することで水が発生する。
可燃性なので、実験時は取扱いに注意。学校の先生の指導をキチンと聞くこと。
作り方
- 亜鉛に、うすい塩酸を加えると、水素が発生する。
- 亜鉛 + 塩酸 → 水素
- または、塩酸(えんさん、hydrochloric acid、ハイドロクロリック・アシッド)などの酸性の溶液と、金属(例えばアルミニウムや鉄)を反応させることで水素を発生させることができる。
集め方
- 水に溶けにくいので、水上置換法で集める。
性質
- 水素は気体の中で、一番、軽い。水素は空気よりも軽いので、かつては飛行船を浮かせるための気体としてヨーロッパなどで用いられたこともある。
- 無色・無臭・無味である。
- 水素には可燃性はあるが、助燃性は無い。そのため、空気中の酸素もふくめて、まったく酸素のない、純粋な水素の中では、燃えない。
アンモニア
[編集]
アンモニア(英:ammonia)は窒素と水素からなる分子であり、性質は匂いの強い気体であり、また水に溶けやすい。アンモニアの水溶液はアルカリ性を示す。アンモニアは空気よりも軽く、補集するときには器具を上に置いて捕集する。(アンモニアは水に溶けるので、水上置換法では集められず、上方置換法でアンモニアを集める必要がある。)
なお、アンモニアのにおいを確認するときは、手であおぐなどして、アンモニアから鼻のほうへ風を送って、においを確認する。
けっして、直接、鼻を近づけて確認してはいけない。鼻を近づけて確認すると危険である。
アンモニアの作り方
- 塩化アンモニウムと水酸化カルシウムを混ぜて、加熱する。
- 塩化アンモニウム + 水酸化カルシウム → アンモニア
- 性質
- 無色である。
- 刺激臭があり、有毒。けっして直接、鼻で、臭いをかいではいけない。かぐときは、手であおいで、間接的に臭いをかぐ。
- (※ 画像募集中。アンモニアなどの臭いをかぐ時の、かぎかたの説明画像。)
- 水に良く溶ける。そのため、水上置換法では、集められない。
- 空気より軽く、水に溶けてしまうので、集めるときは上方置換法で集める。
- 水溶液は、アルカリ性をしめす。赤色リトマス紙を青色に変える。BTB溶液の緑色(=中性)から、BTB溶液を青色(=アルカリ性)に変える。また、フェノールフタレイン溶液を赤くする。(アルカリ性のもとでは、フェノールフタレイン溶液は赤くなる。)

- 燃えない。可燃性も助燃性も無い。
- アンモニアは塩化水素と反応して、白煙を生じる。塩化水素は塩酸にふくまれている。アンモニアの確認に、この反応が用いられる。実験する時は、ガラス棒の先に濃い塩酸をつけて、そのガラス棒を気体の入った集気ビンなどの口に近づける。
窒素
[編集]窒素(ちっそ)は、大気の80%を占める気体であり、水に溶けにくく、化学反応を起こしにくい性質を持つ。
性質
- 無色であり、においは無い。
- 空気よりも、わずかに軽い。
- 水に溶けにくい。
- 燃えない。助燃性も可燃性も無い。
- 化学的に安定している。
空気
[編集]大気中の空気は、主に、80%ちかくは窒素であり、20%ちかくが酸素である。なお、水蒸気は、空気の成分にはふくめないのが一般的である。大気中の空気のうち、二酸化炭素などは、ごくわずかである。
その他の気体
[編集]危険な性質のため、中学校では実験をして生成する機会は無いが、他にも知っておくべき気体がある。
- 二酸化硫黄
- 硫黄を燃やしたときに、できる物質である。火山ガスにもふくまれる。
- 有毒である。
- においは刺激臭であり、卵のくさったようなにおいがする。
- 空気よりも重い。二酸化硫黄の密度は、空気の2.3倍。
- 水に溶けやすい。水溶液は酸性である。
- 漂白作用がある。
- 酸性雨の原因の物質の一つでもある。
- 塩素
- 有毒である。かなり毒性が強い。
- 黄緑色をしている。刺激臭がある。
- 空気より重い。塩素の密度は、空気の約2.5倍。
- 水に溶けやすく、水溶液は酸性である。
- 水溶液には漂白作用や殺菌作用がある。そのため、洗剤などにも用いられている。
プールの消毒剤や、水道水の消毒にも、塩素が用いられている。
- 塩化水素
- 無色である。刺激臭がある。有毒である。
- 水に溶けやすく、水溶液は塩酸であり、強い酸性をしめす。
- 一酸化炭素
- 有毒であり、かなり毒性が強い。酸素が不足した不完全燃焼で発生する。
不完全燃焼をふせぐため、物を燃やすときには、換気をする必要がある。
- メタン
- 都市ガスの主成分。
- 無色。無臭である。 都市ガスでは、ガスもれを分かりやすくするため、いやな臭い(におい)がつけてある。
- 水に溶けにくい。
- プロパン
- LPガスの主成分。
- 無色。無臭である。
都市ガスもプロパンガスも、主成分のメタンやプロパンそのものには、においが無い。ガスもれを気づきやすくするという、安全上のため、いやな臭い(におい)がつけてある。
メタンは空気よりも軽いので、ガスが漏れたときは、上のほうに たまる。プロパンは空気よりも重いので、ガスが漏れたときは、下のほうに たまる。
- ブタン
- カセットコンロの燃料の気体として利用されている。
- 無色。無臭である。
| 気体 | 色 | におい | 密度/(g/L) | 水に対する 溶けやすさ |
その他の性質 |
|---|---|---|---|---|---|
| 二酸化炭素 | ない | ない | 1.84 (空気の1.5倍) |
少し溶ける。 水溶液は酸性。炭酸水。 |
石灰水を白くにごらせる。 |
| 酸素 | ない | ない | 1.33 (空気の1.1倍) |
溶けにくい。 | ものを燃やす働きがある。 空気中のおよそ の割合をしめる。 |
| 水素 | ない | ない | 0.08 (空気の0.07倍) |
溶けにくい。 | 火をつけると酸素と化合して、はげしく燃えて、水ができる。 |
| アンモニア | ない | 刺激臭 | 0.72 (空気の0.60倍) |
とても溶けやすい。 水溶液はアルカリ性。 |
有毒。 水溶液は、アルカリ性なので、赤色リトマス紙を青くする。 |
| 窒素 | ない | ない | 1.16 (空気の0.97倍) |
溶けにくい。 | 燃えない。 空気中のおよそ の割合をしめる。 化学的に安定しており反応しづらい。 |
| 塩素 | 黄緑色 | 刺激臭 | 3.00 (空気の2.5倍) |
溶けやすい。水溶液は酸性。 | 有毒。 漂白作用・殺菌作用がある。 |
| 塩化水素 | ない | 刺激臭 | 1.53 (空気の1.3倍) |
とても溶けやすい。 水溶液は酸性であり、希塩酸である。 |
水溶液は酸性なので、赤色リトマス紙を青くする。 |
水溶液
[編集]水溶液の性質
[編集]砂糖を水に溶かすと砂糖水ができる。食塩を水に溶かすとこのとき、食塩水ができる。
- 溶質(ようしつ) ・・・ 水にとかした砂糖や食塩のように、水に溶けている物質を溶質(ようしつ、solute、ソリュート)という。
- 溶媒(ようばい )・・・ 砂糖水や食塩水での、水のように、溶質を溶かしている液体を溶媒(ようばい、solvent、ソルベント)という。
- 溶液(ようえき) ・・・ 溶質が溶媒に溶けた液を溶液(ようえき、solution、ソリューション)という。砂糖水や食塩水は溶液である。
- 水溶液(すいようえき) ・・・ 溶媒が水の溶液を水溶液(すいようえき、aqueous solution)という。砂糖水や食塩水は水溶液である。
- 水溶液の性質
- 水溶液は透明である。色は無色とは、かぎらない。溶質によっては、色が付いている場合もある。たとえば硫酸銅の水溶液は青くて透明である。「透明」とは、向こう側が見えるかどうかのことであって、色がついているかどうかとは無関係である。
- 溶液中での溶質の濃さはどの部分でも同じである。
- 水溶液は放置しても、温度が変わらなければ、溶質は溶けたままであり、透明なままであり、溶質がしずんだりしないし、にごったりもしない。
- 溶質は、固体とは、かぎらない。気体や液体が溶質の場合もある。たとえば炭酸水は、二酸化炭素という気体がとけた水溶液である。
- 砂糖や食塩が水に溶けても、消えたわけではないので、重さは残る。そのため、くわえた砂糖や塩のぶんだけ、水溶液の重さは増える。
たとえば何も溶かしていない水100gが入ってるビーカーに、食塩を20gくわえて溶かすと、食塩水の水溶液の重さは120gになる。(なお、水100gに対し、温度20℃では食塩は37gくらいまで溶ける。) たとえ、溶質を多く くわえすぎて、溶けのこりが出ても、ビーカー内の重さは はじめの水の重さと加えた溶質の重さの合計であり、質量は失われない。

- 溶質は、ろ紙(ろし)を通過する。
- 石灰水そのものは、水酸化カルシウムのとけた水溶液であり、透明である。二酸化炭素を通して白くにごるのは、二酸化炭素を通すと溶質が変化をして炭酸カルシウムという溶けない白色の物質に変わったからである。
- 硫酸や塩酸も、水溶液である。
- ろ紙の使い方
- ろうと台を用いる。
ろ紙の選び方は、折って開いたあとに、ろうとの8分目ぐらいの大きさになる物をえらぶ。
ろ紙の折り方
 |
 |
 |
- 二つ折りにする。 → 4つ折りにする。 → 円すい形に ひらく。 → ろうと に はめる。 → ろ紙に水をつけて、ろうとに接着させる。
- (※ 画像を募集中。ろ紙の折り方・使い方を説明する画像を、だれか描いてください。)
- ろうとの先は、ろ過後の液体の入るビーカーの口につける。ろうとの先がナナメに とがっているので、とがって長くなってる側を受け入れ側のビーカーにつける。
- ろ過させたい液体は、ガラス棒を伝わらせて、入れる。ろ過前の液体の入ってるほうのビーカーの口は、ろうとの上にある。ろ過前の液体の入ってるほうのビーカーの口は、直接は ろうと に、ふれない。
- ろ過させたい液体を、ろ紙の8分目くらいまで入れる。入れすぎないようにする。
牛乳は、不透明です。しかし、牛乳を放っておいても、沈殿は出来ません。いっぽう、ふつうの泥水(どろみず)は、放っておくと、沈殿ができます。
牛乳のような、水溶液ではないけれど、沈殿もできない液体を、コロイド溶液(コロイドようえき)といいます。
血液や墨汁も、コロイド溶液です。
コロイド溶液は、粒子がとても小さいので、水となじんで、沈殿をしないのです。
コロイド溶液では、粒子は、液体中に均等に分散しています。
コロイド溶液を、無理に水と粒子に分けるには、遠心分離機(えんしん ぶんりき)という装置を使います。(※ 遠心分離機の装置が高度なので、中学生は、実験しなくていい。)

牛乳のほか、書道などで使う墨(すみ)も、コロイドです。墨を放置しても、沈殿しません。
- ※ 参考書では、受験研究社がコロイドを紹介している。受験研究社は述べてないが、昭和の昔から、小学生レベルくらいの科学図鑑で、コロイドと次のチンダル現象は、定番の内容。
うすいコロイド溶液に、ペンライトでもレーザーポインターでも何でも良いですが、細い光を当てると、光の通路が見えます。これをチンダル現象と言います。
いっぽう、純粋や水溶液に光を当てても、通路は見えないです(受験研究社)。
質量パーセント濃度
[編集]水溶液の溶質の濃さを数値化したものを濃度(のうど、concentration、コンセントレイション)と言う。
水溶液の濃度を表す場合は、いろいろな表し方がある。このうち、よく用いられる質量パーセント濃度の表し方を説明する。 水溶液の全体の質量(溶媒の質量だけでなく、水溶液全体の質量)に対する、溶質の質量をパーセント表示したものが、質量パーセント濃度である。
式で表すと、
- 質量パーセント濃度[%] = { 溶質の質量[g] / 溶液の質量[g] }× 100
| 質量パーセント濃度[%] = | 溶質の質量[g] 溶液の質量[g] |
× 100 |
あるいは
- 質量パーセント濃度[%] = { 溶質の質量[g] / (溶質の質量[g] + 溶媒の質量[g] ) }× 100
| 質量パーセント濃度[%] = | 溶質の質量[g] 溶質の質量[g] + 溶媒の質量[g] |
× 100 |
である。
飽和と溶解度
[編集]ある物質を一定量の水に溶かしていき、その物質がもうこれ以上は溶けきれなくなったときのことを飽和(ほうわ、saturation、サチュレイション)という。
- 水100gに対し、温度20℃では食塩は37gくらいまで溶ける。
- 水100gに、温度20℃では砂糖は200gくらいまで溶ける。
- 飽和水溶液(ほうわ すいようえき) ・・・ 飽和した状態の水溶液を飽和水溶液(ほうわすいようえき、saturated solution など)という。
- 溶解度(ようかいど) ・・・ 水100gに物質を溶かして飽和水溶液にしたとき、溶けた溶質の質量をその物質の溶解度(ようかいど、solubility、ソリュビリティ)という。物質ごとに溶解度はちがう。
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|
| 砂糖 | 179 | 204 | 238 | 287 | 362 | 485 |
| 塩化ナトリウム | 35.6 | 35.8 | 36.3 | 37.1 | 38.0 | 39.3 |
| 硝酸カリウム | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
| ホウ酸 | 2.7 | 5.0 | 8.7 | 14.8 | 23.6 | 40.3 |
| 硫酸銅 | 14.3 | 20.7 | 28.5 | 40.0 | 55.0 | 75.4 |
| 水酸化カルシウム | 0.14 | 0.13 | 0.11 | 0.09 | 0.07 | 0.05 |

どの溶質も、温度が高くなると、溶解度は増えるが、その増え方の度合いは物質ごとにちがう。
食塩(塩化ナトリウム)は、あまり温度によって溶解度が、ほとんど変わらない。
ミョウバンは、温度によって、溶解度が、急激に変わる。
水溶液から出てきた固体をルーペや顕微鏡で観察すると、その物質に特有な規則正しい形をしていることがわかる。純粋な物質で規則正しい形をした固体を結晶(けっしょう、crystal、クリスタル)という。
物質をいったん溶媒に溶かし、温度を下げたり溶媒を蒸発させたりして再び結晶として取り出す操作を再結晶(さいけっしょう)という。再結晶により物質をより純粋にすることができる。
物質の状態変化
[編集]

水を摂氏0℃まで冷やすと氷(こおり)になったり、100℃にすると沸騰して水蒸気になるように、同じ物質でも、温度によって状態が変わる。
水に限らず、物質は温度によって、状態が変わり、固体(こたい)、液体(えきたい)、気体(きたい)の三種類のうちのいずれかをとる。
食塩(塩化ナトリウム)は約800℃で液体になる。鉄は約1500℃で液体になる。窒素は約 -200℃(マイナス200℃)で液体になる。
食塩を融解させる実験はふつうの試験管では出来ない。耐熱試験管やルツボなどを用いる必要がある。
- 固体(こたい)
氷(こおり)や鉄や木や紙や布などのような物体。固体の内部では、粒子は、規則ただしく整列している。
- 液体(えきたい)
水(みず)やアルコールなどのような、流れることのできる物体。 液体は、容器によって形は変わるが、体積は変わらない。液体では、粒子どうしは整列しておらず、自由に動けるので、形が変わる。 粒子の間隔(かんかく)は、固体よりも広い。
- 気体(きたい)
空気や酸素や二酸化炭素のような物体。 容器の仲に広がり、容器によって体積は変わるし、形も変わる。気体では、粒子は飛び回っており、粒子と粒子の間隔は、とても広い。
|
|
物質が、固体から液体に変化したり、液体から固体に変化したり、液体から気体に変化したり、気体から液体に変化することを状態変化(じょうたい へんか)という。
状態変化をしても、物質そのものは他の物質には変化せず、また質量は変化しない。 温度が高くなるほど、物質を構成している粒子の運動は激しくなる。そのため、一般に温度が高くなるほど、体積がふえる。ただし、氷から水への変化は例外であり、4℃のときがもっとも密度が大きい。
液体が気体になることを気化(きか)という。
水を熱して100℃に近づけると、容器の底の方の水が泡立つが、これは水に溶けていた空気が気化したものである。この現象を沸騰(ふっとう)という。
水が気体になったものを水蒸気(すいじょうき、water vapor、ウォーター ベイパー)という。水から水蒸気に変化すると体積は元の水の約1700倍にも変化する。いっぽう水蒸気から水になると、体積は元の水蒸気の約 倍になる。
沸騰の実験を行うときは、急激に沸騰すると、湯が吹き飛んで危険なので、急激な沸騰を防ぐために沸騰石(ふっとうせき、boiling chip)を加える。なお、急激に沸騰することを突沸(とっぷつ)という。
一度、使用した沸騰石は再利用してはいけない。沸騰石が突沸を防止できるのは最初の一回だけである。また、長期間、液体につけた沸騰石も能力を失う。
物質の融点と沸点
[編集]ここでは物質のw:沸点とw:融点について説明する。物質は温度や圧力を変化させることで"気体"(きたい、gas、ガス)、"液体"(えきたい、liquid、リキッド)、"固体"(こたい、solid、ソリッド)の間を移り変わることが知られている。
ここでは特に、温度による変化について述べる。
上であげた"気体"、"液体"、"固体"のことを物質のw:三態(さんたい)と呼び、これらの間の変化をw:状態変化(じょうたいへんか)と呼ぶ。特に、状態変化のうち固体から液体への変化をw:融解(ゆうかい、Melting)と呼び、液体から気体への状態変化をw:蒸発(じょうはつ、evaporation)と呼ぶ。また、融解が起こる温度を融点(ゆうてん、melting point)と呼び、蒸発が起こる温度を沸点(ふってん、boiling point)と呼ぶ。日常的な例では水の温度を 摂氏0度 にすることで水を固体にすることができる。また、水の温度を摂氏100度にすることで、水をw:水蒸気にすることができる。これらは状態変化の例である。
純物質の状態変化の際に物質の温度変化を観察すると、特徴的な結果が観察できる。
液体の沸点
[編集]- 実験
氷などの物質を状態変化させその温度変化を観察せよ。特に物質の状態変化が続いているときの温度に着目せよ。


- (※ 実験結果の温度曲線の画像を募集中。だれかプロットするかして描いてください。)
氷が水になるとき、しばらく温度変化しない時間がつづく。
この実験では、熱を加え続けても、状態変化が続いているときには物質の温度は変化しないことが観察できる。これは、加えた熱が、状態変化のためのエネルギーに用いられるからである。つまり、氷がとけるために、加えられた熱エネルギーが用いられているので、しばらく温度が変化しない。
ただし、ロウのような混合物では、状態変化をしている時でも、温度は変化する。混合物の加熱実験では、融解中でも、温度が上がりつづける。
純物質の場合でだけ、固体がとけているときに、しばらく温度が変化しない現象が起きる。のは、純物質の場合のみである。
固体から液体になるときだけでなく、液体から気体になる沸騰のときでも、温度は一定である。 たとえば水を沸騰させると、水温は100℃の状態がつづく。
水にかぎらず、純粋な物質なら、融解や沸騰のときには、しばらく温度が変わらない。
一般に純物質の融点と沸点は、(同じ圧力では)物質ごとに決まった値を持つ。このことは、混合物を分離するために利用することができる。 「(同じ圧力では)」と書いたのは、沸点は気圧によって変わるからである。たとえば高い山の頂上付近では、沸点が下がる現象がある。 通常の標高の低い場所では水の沸点は100℃だが、たとえば日本の富士山の頂上付近では水の沸点は約88℃で沸騰が始まる。
- 食塩水の加熱
食塩水などのように、かなりの高温にしないと融解しない固体の物質(食塩の主成分の塩化ナトリウムの融点は約800℃と、水の沸点を大きく上まわっている。)が溶けている水溶液を考える。
まず、食塩水は、沸点が100℃よりも少しだけ高くなる。この現象を沸点上昇(ふってんじょうしょう、boiling-point elevation)という。
食塩水を加熱すると、沸点で水だけを含む純粋な水蒸気が得られる。水蒸気には、食塩は含まれていない。
この蒸気を冷ませば、純粋な水が得られる。このように蒸発を利用して、溶液から液体を分離する方法を蒸留(じょうりゅう、distillation)という。
- 水とエタノールの混合液体の加熱
- (※ 水とエタノールの混合液体の温度曲線の画像を募集中。だれか描いてください。)
水とエタノールの混合液体のような液体どうしの混合物について、加熱をした時の温度変化を観察する同じ実験を行うと、状態変化の最中にも混合物全体の温度が変化することが観察できる。 たとえば、純粋なエタノールの沸点は、約78℃だが、混合液体だと、78℃くらいで沸騰が始まってからも、温度の上昇は緩やかになるが、それでも温度はなだらかに上昇していく。これが純物質の蒸発とは違う性質である。78℃くらいで蒸発が始まった時の蒸気にはエタノールの成分が多く含まれているが、少しだけ水蒸気も含まれている。このように、純物質の蒸発とは、少しちがう現象がおきる。
水とエタノールの混合液体の加熱をつづけて、80℃から82℃、85℃、88℃、92℃、93℃、95℃・・・・・・と加熱を続けていくと、100℃の手前で、温度上昇がゆるやかになり、100℃以上は上がらない。 この100℃あたりの蒸気を調べると、水を多く含むが、エタノールもすこしだけ含む。
このように、温度によって、蒸気に多く含む物質が異なるので、異なる今度での蒸気を分けて集めることで、物質の純度を高めることができ、この方法で純度を高めることを分留(ぶんりゅう)という。
- 水とエタノールの分留
例えば沸点がより低い物質の沸点近くに温度を保ったとき、蒸発した気体には沸点が低いほうの物質が多く含まれると考えられる。 蒸気を集めて、それを冷やして液体に戻すと、沸点の低いほうの物質を多く含む液体が得られる。
この手法で物質を分離することを蒸留(じょうりゅう)と呼ぶ。蒸留はw:原油(げんゆ)を精製する際に用いられるなど多くの応用がある。(詳しくはw:蒸留を参照。)
水の蒸気にも少しだけエタノールが含まれるように、分留では完全に分離することは不可能である。純度を上げるためには、分留で分離した異なる温度での蒸気を、冷まして液化させた後に、また蒸発させて分留をして、さらにその異なる温度での蒸気を冷まして液化させたものを再び分流して・・・・というふうに、何回も分留を繰り返すことによって、純度をあげている。
- 気圧と沸点
融点と沸点は物質にかかる、大気の圧力によって変化することが知られている。例えば、高山で水を沸騰させるには100度より低い温度で十分なことが知られている。これは高山ではw:大気圧がより低いため、水を蒸発させるのに必要なエネルギーが減るからである。
- 質量との関係
物質が状態変化を起こすとき物質の体積は変化するが物質の質量は変化しないことを説明する。このことは例えば、"氷をコップに入れて重さを測り、氷が融けた状態での重さと比較する"などの実験を行うことで確認できる。 状態変化は分子と分子と間の相互作用を変化させるが、分子自体は変化させない(物質が分子と呼ばれる小さい粒でできていることは後に説明する)。例えば、固体では個々の分子間の距離は近く分子が自由に動くことができない一方、気体では分子が自由に動くことができる。このときにも分子自身の数や重さが変化するわけではないため、状態変化によって物質の質量は変化しない。
蒸留と石油化学
[編集]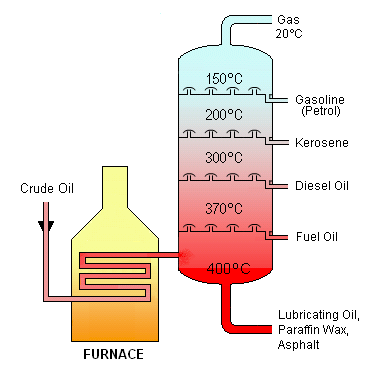
最上は石油ガス。
35℃〜180℃: ガソリンおよびナフサ。
170℃〜250℃: 灯油およびジェット燃料。
240℃〜350℃: 軽油。
350℃以上: アスファルト。
温度は、おぼえなくてもよいです。
石油化学産業とは、石油を原料として、さまざまな製品をつくる産業である。 ほとんどのプラスチックは、石油を原料にして作られている。たとえば、ビニル袋などのビニル製品、合成ゴムなどのプラスチックは、石油から作られるのが通常である。
また、灯油や軽油やガソリンなども、石油から作られている。
- 原油
地中から取り出したままの石油を原油(げんゆ)という。この原油が、石油工業の、おおもとの原料である。 原油そのものでは製品にはならず、この原油を工場で成分ごとに分けます。これを石油の精製(せいせい)といいます。
蒸留塔(じょうりゅうとう)で、成分ごとに分けられます。 石油の蒸気は、温度によって、ふくまれる成分の割合がかわってくるので、この現象を利用して、成分ごとに分けています。蒸留塔の中には、数十段ものトレイ( 棚(たな)のこと )が組み込まれています。図では、トレイが数段ですが、じっさいには、もっと多いです。このように、成分ごとに沸騰(ふっとう)する温度のちがいで物質をわけることを、 分留(ぶんりゅう) と言います。
精製によって、原油は成分ごとにわかれ、ガス、ガソリン、ナフサ、灯油、軽油、アスファルトなどに分かれ、分留されます。分留された成分のことを留分(りゅうぶん)と言うことがあります。「ガソリン留分」、「ナフサ留分」、「軽油留分」などのように言います。ガソリン留分からガソリンがつくられ、軽油留分から軽油が作られます。
ナフサは、プラスチックなど、さまざまな製品の原料になります。ナフサを分解するナフサ分解炉(ぶんかいろ)で、エチレンやプロピレン、ブタジエン、ベンゼン、トルエンなどのガスの成分が、とり出されていきます。
これらエチレンなどの成分から、プラスチックや合成繊維(ごうせいせんい)、合成ゴム(ごうせいゴム)などの誘導品(ゆうどうひん)を作っていきます
プラスチックのポリエチレンは、エチレンを原料に作られます。ポリプロピレンは、プロピレンを原料に作られます。
融解と凝固
[編集]
固体から気体になる昇華の例としては、たとえばドライアイス(固体の二酸化炭素)があります。
- 凝固
水(みず)を冷やすていくと摂氏0℃で氷(こおり)になる。このように、ほとんどの液体は、冷やしていくと固体になる。液体が固体になることを凝固(ぎょうこ、freezing)と言い、そのときの温度を凝固点(ぎょうこてん、freezing point)と言う。 凝固が終わりきるまでの、水(みず)と氷(こおり)が混じっている混合物のときの温度は0℃のままである。
凝固が終わり、水(みず)がすべて氷(こおり)になった氷(こおり)を冷やしていくと、さらに温度を下げることが可能である。
いっぽう、氷を加熱していくと、摂氏0℃で溶け始め水になっていく。溶け終わるまでの間は、氷と水の混合物の温度は0℃のままである。
- 融解
このように、固体は加熱していくと、たいていの物質では液体になる。加熱された固体が液体になることを融解(ゆうかい)という。 そして、加熱された物質が融解するときの温度を融点(ゆうてん、melting point)と言う。
一般に、ふつうの物質では、凝固点と融点とは同じ温度である。
- 過冷却
凝固点まで冷やしても、凝固が開始しない場合がある。この場合、ほんの少しの振動などを液体に加えたりすると、凝固が開始するのが一般である。
凝固点で凝固が開始しない場合に、凝固を開始させないように静かに冷却を続けていくと、凝固点より低い温度でも、液体でいられる。この現象を過冷却(かれいきゃく、supercooling、スーパー・クーリング)という。
電気的な性質
[編集]次に電気伝導度(でんき でんどうど)について説明する。後に扱うが、物質に流れる電気とは、w:電子(でんし、electron、エレクトロン)の流れのことであり、物質に電気が通りやすいかどうかは、物質の性質によって決まる。電気伝導度は、物質が電気を通しやすいかどうかを表す値であり、物質ごとに決まる定数である。この値は、物質が持つ電子の状態によっており、密度と同様に微視的に決まる値である。
例えば、流れて来た電子が入り込む部分が、既に他の電子によって埋まっている場合には、その物質は電気を通しにくくなる。一方、電子が非常に動きやすい状態になっている物質では、流れてきた電子が他の電子を押し出して電子の流れを伝えるため、電気が流れやすくなる。これらは物質ごとの結合の性質によって変化することが知られているが、ここでは詳しくは扱わない。(詳しくは高等学校化学などを参照。)
さいわいにも電気の通りやすさには物質の種類ごとにある程度の共通性がある。ここではその性質についてまとめる。
- 実験
物質に対して電気を流す実験を行う。特に、いくつかの金属について電気が通りやすいことを確認する。水溶液について実験を行うときには十分に安全上の注意を払うこと。
実験の結果から金属については電気が通りやすいことがわかる。(これは、金属原子間の結合方法によっているが、これについては高等学校化学、w:金属結合などを参照。)。 一般に電気を流すためにはw:導線が用いられるが、導線の材質には通常何らかの金属が用いられる。これは金属の電気伝導度が高いことに加え、丈夫であることや加工が可能であることによるものである。
- 発展 雷と金属
電気が関わる現象としてw:雷がある。
雷は、雲の中の水滴と地面との間に非常に高い電圧が生じた結果、本来なら電気を通しにくい大気中を電気が通過していく現象である。電気は基本的に電気を通しやすい物質に向かっていく傾向があるため、電気伝導度の高い金属製の物体は雷を呼びやすく、注意が必要である。一方、この性質を利用して雷を誘導する器具としてw:避雷針がある。
また、物質によっては固体の時に電気を通さなかった物質で、水溶液にすることで電気を通すようになる物質もある(w:食塩など)。これらの物質は大抵はw:イオン結合(ionic bond)によって結合する物質である。(詳しくは高等学校化学を参照。)
- 発展 物質の色
物質の性質として目につきやすいものとして、その物質の色があげられる。残念ながら物質の色について一般的に述べることは難しい。これは、物質に色がついて見えるのは、物質がある色(w:波長)の光を選択的に反射していることに対応するのだが、その仕組みが物質のミクロの構造によることが多いからである。例えば、w:ダイヤモンド(diamond)とw:黒鉛(こくえん、graphite、グラファイト)は同じ炭素原子(たんそげんし)からできていることが知られているが、これらの色は全く異なる。
これは、これら2つの物質では原子の並び方が異なっており、光に対する反応が違うからである。このように物質の色について調べるには光についての知識が必要となるため、ここでは細かく扱うことはしない。(詳しくは高等学校物理などを参照。)
発展
[編集]材料
[編集]生分解性樹脂
[編集]プラスチックは、くさりにくい種類のものが多い。なので、農業用のフィルムなど、自然界でつかうプラスチックでは、やぶれたりして散らばったりすると、ちらばった破片などが、自然界で、くさらずにのこり続けてしまうので、ゴミとして、のこり続けてしまう、という問題があった。
そこで、自然界で分解されやすい、生分解性樹脂(せいぶんかいせい じゅし、biodegradable polymer)が、開発された。
なお、生分解性樹脂などが、自然界で分解されることを生分解という。
生分解性樹脂の成分は、種類にもよるが、おもに、タンパク質の生分解樹脂もあれば、あるいは、乳酸(にゅうさん)をもとに得られるポリ乳酸や、あるいはグリコール酸をもとにポリグリコール酸のものや、あるいはデンプンやセルロース、キトサンなどからつくられるものがある。微生物などの作用によって、これらの生分解性樹脂は、しぜんに分解される。
外科(げか)手術用の縫合糸(ほうごうし)に、抜糸(ばっし)の必要がないため、ポリ乳酸やポリグリコール酸の糸が使われている(※ 高校理科の啓林館、東京書籍の検定教科書に記述あり)。
熱可塑性と熱硬化性
[編集]プラスチックの種類のうち、高温に熱すると柔らかくなり、冷やすとかたくなるプラスチックを熱可塑性プラスチック(ねつかそせいプラスチック)という。
いっぽう、別の種類のプラスチックとして、加熱しても軟化せず、加熱によってかたくなり、また、冷やしても軟化しないプラスチックを熱硬化性プラスチック(ねつこうかせいプラスチック)という。
プラスチックのことを「樹脂」(じゅし)あるいは「合成樹脂」(ごうせいじゅし)とも言う。
- 熱可塑性プラスチックの一覧
- ポリスチレン - 発砲スチロールなど
- ポリ酢酸ビニル - 接着ボンド
- ポリエチレン - スーパーマーケットなどで渡される透明のレジ袋は、ポリエチレン製である場合が多い。
- ポリプレピレン -
- ポリ塩化ビニル -
- ポリエチレンテレフタラート - ペットボトルの材料
これらのプラスチックが、熱可塑性である。
塩化ビニルは、燃やすと有害な気体がでるので、無理に、これらのプラスチックの加熱の実験しなくて良い。
- 熱硬化性プラスチックの一覧
- フェノール樹脂 -
- 尿素樹脂(にょうそ じゅし)、「ユリア樹脂」ともいう、
- メラミン樹脂
- アルキド樹脂
導電性高分子
[編集]2000年にノーベル化学賞を白川英樹(しらかわ ひでき)が取ったことでも有名な導電性高分子とは、 ポリアセチレンに、少量のヨウ素や臭素(しゅうそ)を加えたものである。